
�״�����Ϊ21���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
(1)��1.0 mol��CH4��2.0 mol��H2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊ100 L)����һ�������·�����Ӧ��CH4(g)��H2O(g)![]() CO(g)��3H2(g)������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)��3H2(g)������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
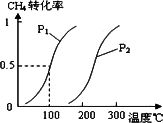
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5 min������H2��ʾ��ƽ����Ӧ����Ϊ________��
��ͼ�е�P1________P2(�����������������)��100��ʱƽ�ⳣ����ֵΪ________��
���������������������½����¶ȣ��淴Ӧ���ʽ�________(�������С�����䡱)��
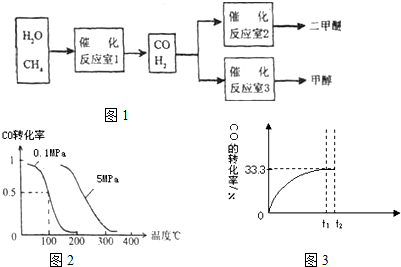
(2)��ѹǿΪ0.1 MPa�����£���a mol��CO��3a mol��H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO(g)��2H2(g)![]() CH3OH(g)������
CH3OH(g)������
�ܸ÷�Ӧ�Ħ�H________0����S________0(�����������������)��
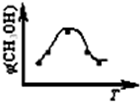
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���________��
A�������¶�
B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1 mol��CO��3 mol��H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��У�
A�������ϱ��ո�������ʣ���ʵ���������ݣ�
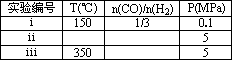
B�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������0.1 MPa��5 MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ���������������ߵ�ѹǿ��

 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�
��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�| 3 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| V2 |
| a2 |
| V2 |
| a2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʵ���� | T���棩 | n��CO��/n��H2�� | P��MPa�� | ||||
| i | 150 |
|
0.1 | ||||
| ii | 150 150 |
|
5 | ||||
| iii | 350 |
|
5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com