
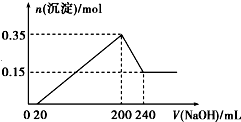
分析 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,从20mL到200mL,生成Mg(OH)2和Al(OH)3,当V(NaOH溶液)=200mL时,沉淀量最大,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,从200mL到240mL,NaOH溶解Al(OH)3,发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol.
(1)根据Mg、Al原子守恒计算各自物质的量,再根据m=nM计算各自质量,进而计算Mg的质量分数;
(2)从200mL到240mL,NaOH溶解Al(OH)3,根据方程式计算消耗NaOH的物质的量,再根据c=$\frac{n}{V}$计算NaOH溶液的浓度;
消耗200mLNaOH溶液时,沉淀到达最大值,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)=$\frac{1}{2}$n(NaOH),进而计算硫酸的物质的量浓度.
解答 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,从20mL到200mL,生成Mg(OH)2和Al(OH)3,当V(NaOH溶液)=200mL时,沉淀量最大,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,从200mL到240mL,NaOH溶解Al(OH)3,发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol.
(1)由元素守恒可知n(Mg)=n[Mg(OH)2]=0.15mol,m(Mg)=0.15mol×24g/mol=3.6g,n(Al)=n[Al(OH)3]=0.2mol,m(Al)=0.2mol×27g/mol=5.4g,则Mg的质量分数为$\frac{3.6g}{3.6g+5.4g}$×100%=40%,
故答案为:40%;
故m(Mg)=0.15mol×24g/mol=3.6g,m(Al)=0.2mol×27g/mol=5.4g,
(2)由上述分析可知,从200mL到240mL,NaOH溶解Al(OH)3,根据方程式可知n(NaOH)=n[Al(OH)3]=0.2mol,则c(NaOH)=$\frac{0.2mol}{0.24L-0.2L}$=5mol/L,
沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)=$\frac{1}{2}$×0.2L×5mol/L=0.5mol,n(H2SO4)=n(Na2SO4)=0.5mol,则c(H2SO4)=$\frac{0.5mol}{0.5L}$=1mol/L,
故答案为:5mol/L;1mol/L.
点评 本题以图象题的形式考查混合物计算、镁铝的重要化合物性质,明确各阶段发生的反应是解题关键,注意利用守恒法进行的计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4(或HNO3、H2CO3) | ③NaOH(或KOH) ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO4 | ⑦CO2 ⑧Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外小组使用铁丝做催化剂,用下图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组使用铁丝做催化剂,用下图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 在相同条件下,分别加热Na2CO3固体和NaHCO3固体 | NaHCO3固体分解,产生气体使澄清石灰水变浑浊,Na2CO3固体并没有分解 | Na2CO3固体的稳定性比NaHCO3好 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都可以与水反应生成氢气和碱 | |
| B. | 都能从硫酸铜溶液中置换出铜 | |
| C. | 去除铝表面的铜镀层可以选用稀硝酸 | |
| D. | 铁丝不论在空气中还是在纯氧中都可以发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com