
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| ||
| 0.5L |
| W |
| 63 |
| 2 |
| 5 |
| c(标准)×V(标准) |
| V(待测) |
| 2 |
| 5 |
| ||
| V |
| 10W |
| 63V |
| 10W |
| 63V |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
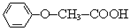 )发生酯化反应的产物.
)发生酯化反应的产物.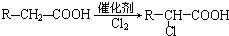 ,R-ONa
,R-ONa| Cl-R′ |
| △ |
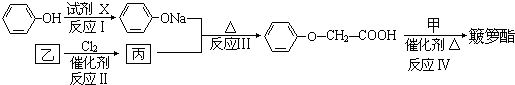
查看答案和解析>>
科目:高中化学 来源: 题型:


| 沸点/°C | 密度/g?cmˉ3 | 水中溶解性 | |
| 苯甲酸 | 249 | 1.2659 | 微溶于水 |
| 甲醇 | 64.6 | 0.7910 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.0900 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com