
| ||
| ||
| ||
| ||
| 3,36L |
| 22.4L/mol |
| 4.48L-3.36L |
| 22.4Lmol |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
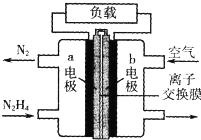
| A、b极发生氧化反应 |
| B、OH-问b极移动 |
| C、放电时,电流从a极经过负载流向b极 |
| D、a极的电极反应式:N2H4+4OH--4e-=N2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室少量的钠保存在煤油中 |
| B、氢氟酸(HF)保存在无色的玻璃瓶中 |
| C、氢氧化钠溶液保存在带橡皮塞的玻璃瓶中 |
| D、新制的氯水保存在棕色玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸钠可用作防腐剂,但不宜过量 |
| B、苯甲酸钠可用作防腐剂 |
| C、醋可同时用作防腐剂和调味剂 |
| D、我国应禁止使用味精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,促进CO32-水解,pH增大 |
| B、离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| C、离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、离子浓度:c(Na+)>c(CO32-)>c(H+)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂 |
| B、SO2有漂白性,工业上常用它来漂白纸浆 |
| C、单质硅具有半导体性能,可以制成光电池 |
| D、Fe2O3是一种红棕色粉末,常用作红色油漆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com