
下列表示对应化学反应的离子方程式正确的是( )
A.铜溶于FeCl3溶液:Cu + Fe3+ = Cu2+ + Fe2+
B.Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]- +CO2 = Al(OH)3↓+ CO32-
C.氯化铝溶液中加过量氨水: Al3++3OH— ==Al(OH)3↓
D.次氯酸钠溶液中滴入浓盐酸产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
科目:高中化学 来源: 题型:
我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
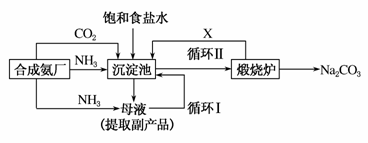

(1)上述生产纯碱的方法称________,副产品的一种用途为________。
(2)沉淀池中发生的化学反应方程式是________________________________________________________。
(3)写出上述流程中X物质的分子式________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是________________________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上冶炼金属钼的化学原理为:
①2MoS2+7O2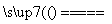 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O = (NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl = H2MoO4↓+2NH4Cl;
④H2MoO4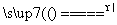 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.上述①③⑤属于氧化还原反应,②④属于非氧化还原反应
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
将同温同压下的NO、NO2、O2三种气体按以下体积比混合后通入水中,气体不能完全溶于水的是
A.1∶2∶1 B.1∶1∶1 C.5∶1∶4 D.6∶2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于阿佛加德罗常数的说法正确的是( )
A.1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA
B.一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA
C.常温下18g铝放入足量浓硫酸中转移电子数2NA
D.0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
用海带灰制备单质碘的实验中,涉及的操作正确且能达到实验目的的是( )
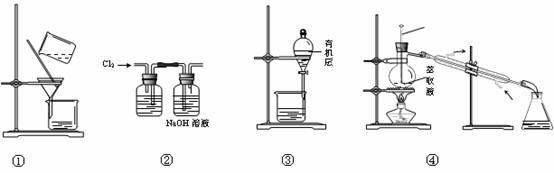
A.用图①所示装置,过滤海带灰浸取液
B.用图②所示装置,在滤液中通入Cl2
C.用图③所示装置,先放出下层液体,再放出有机层
D.用图④所示装置,回收萃取剂苯并获得单质碘
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为中学常见物质, 其中A为单质,B、C、D为化合物,并且存在如下转化关系:试回答下列问题:
其中A为单质,B、C、D为化合物,并且存在如下转化关系:试回答下列问题:
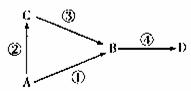
(1)若A为空气的主要成分,B与D为氧化物,试写出D对大气的一种危害 ;
(2)若A为淡黄色非金属单质,B为气态氧化物,是空气的重要污染物之一,C为气态氢化物。试写出B与C反应的化学方程式____
(3)若A为金属单质,且D为红褐色不溶性固体,则反应③的离子方程式为_ 。
(4)B与C为氧化物,D是一种盐,俗名纯碱
①若A为金属单质,写出反应④的化学方程式为 ;
②若A为非金属单质,则符合转化④的一个反应的离子方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:
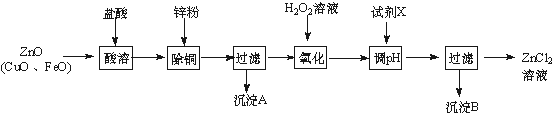
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Zn2+ | 5. 2 | 6. 4 |
| Fe2+ | 5. 8 | 8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为 ▲ 。
(2)流程图中,为了降低溶液的酸度,试剂X可以是 ▲ (选填序号:a.ZnO;b.Zn(OH)2 ; c.Zn2(OH)2CO3 ;d.ZnSO4);pH应调整到 ▲ 。
(3)氯化锌能催化乳酸(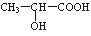 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ▲ ,聚乳酸的结构简式为 ▲ 。
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ▲ ,聚乳酸的结构简式为 ▲ 。
Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)},然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ▲ ;阴极的电极反应为 ▲ 。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A、A、B、E一定在不同周期 B、C的最高价氧化物的水化物可能显碱性
C、A、D可能在同一主族 D、C和D的单质可能化合形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com