
����Ŀ����⾫��ͭ����������Ҫ�ɷ�ΪCu2Te��Ag2Se����ҵ�ϴ����л�����(Se)����(Te)��һ�ֹ����������£�
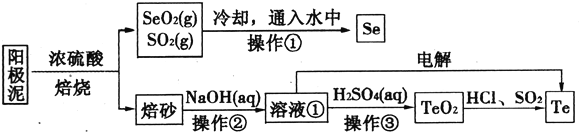
��֪��I��TeO2���������������ˮ��
����Ԫ��������Һ����Ҫ��Te4+��TeO32-��HTeO3-����ʽ���ڣ�
��25��ʱ��������(H2TeO3)��Ka1=1��10-3��Ka2=2��10-8��
��1��NaHTeO3����Һ��pH____7(����>������=������<��)��
��2��SeO2��SO2ͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽΪ________�������ٵ�����Ϊ__________��
��3����ɰ������TeO2��ʽ���ڡ���Һ���е�������Ҫ�ɷ�ΪNaOH��_______����ҵ��ͨ�������Һ��Ҳ�ɵõ������ڡ���֪�缫��Ϊʯī���������ĵ缫��ӦʽΪ____________��
��4������Һ���м������ᣬ������Һ��pHΪ4.5��5.0������TeO2���������H2SO4�������������ڵĻ�����ƫ�ͣ���ԭ����________________________��
��5����������TeO2����������õ����Ȼ�����Һ��Ȼ��SO2ͨ�뵽��Һ�еõ�Te���ʡ������Ȼ��ڵõ�Te���ʵ����ӷ���ʽΪ__________________��
��6�����������п�ѭ�����õ�������__________________(�ѧʽ)��
���𰸡� < SeO2+2SO2+2H2O=2H2SO4+Se�� ���� Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- TeO2����������������Һ���Թ�����TeO2��������ᷴӦ������Ԫ����ʧ Te4++2SO2+4H2O=Te+8H++2SO42- H2SO4��HCl
����������1�������ᣨH2SeO3����Ka1=1��10-3��Ka2=2��10-8����֪HSeO3-��ˮ�ⳣ��![]() ����֪Ka2��Kh������NaHSeO3��Һ�����ԣ�pH��7��
����֪Ka2��Kh������NaHSeO3��Һ�����ԣ�pH��7��
��2����������ͼ��֪��SeO2��SO2��Ӧ������Se���ʣ�����SeO2��SO2����������ʽΪSeO2+2SO2+2H2O=2H2SO4+Se����ͨ�����˿��Խ�Se����Һ���룬�ʴ�Ϊ��SeO2+2SO2+2H2O=2H2SO4+Se�������ˡ�
��3����֪��TeO2���������������ˮ��Ԫ��������Һ����Ҫ��Te4+��TeO32-��HTeO3-����ʽ���ڣ�����TeO2���������Ʒ�Ӧ��Ӧ������Na2TeO3��������Na2TeO3����Һ������Ӧ����TeO32-�õ��ӱ��Te���ʣ����Ե缫��ӦΪTeO32-+3H2O+4e-=Te+6OH-���ʴ�Ϊ��Na2TeO3 ��TeO32-+3H2O+4e-=Te+6OH-��
��4��TeO2����������������Һ���Թ�����TeO2��������ᷴӦ������Ԫ����ʧ��
��5��TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ������ᷴӦʱ�������Ȼ��ں�ˮ�����Ȼ��ڿ��Խ�SO2���������������ӷ���ʽΪ��Te4++2SO2+4H2O=Te+8H++2SO42-��
��6��SeO2��SO2��Ӧ�����������ᣬ����H2SO4����ѭ��ʹ�ã�������TeO2����������õ����Ȼ�����Һ��Ȼ��SO2ͨ�뵽��Һ�еõ�Te���ʵ�ͬʱ�ֻ��ٴ�����HCl�����Կ�ѭ�����õ������У�H2SO4��HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ij��Ԫ��B(OH)2ˮ��Һ�У�B2+��B(OH)+��B(OH)2���߸��Ե����ʵ�������������ҺpH�ı仯������ͼ��ʾ������˵���������(��֪��Ԫ��ĵ��������е�)
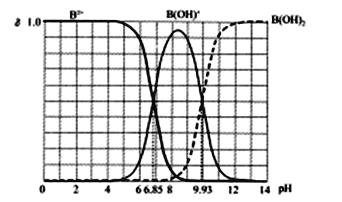
A. Kb2[B(OH)2]��������Ϊ10-8
B. ��B(OH)Cl��Һ��c(OH-)>c(H+)
C. �����ʵ�����BCl2��B(OH)Cl�����Һ����(B2+)<��[B(OH)+]
D. B(OH)Cl��Һ�У���c[B(OH)2]+2c(B2+)+c(H+)-c(OH-)������[B(OH)2]=��[B(OH)+]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������ʵ�ʵ���( )
A. ���MgCl2��Һ��ȡ����þ����ʯī������
B. ��ⷨ������ͭ���ô�ͭ������
C. ��ⱥ��ʳ��ˮ���ռ��Ϳ��̼����������
D. �ڶƼ��ϵ��п����п������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ������84����Һ��ͨ��ϡ��100��(���֮��)��ʹ�á���ش��������⣺
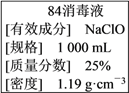
��1������Һ�������ʵ���Ũ��ԼΪ______ mol��L��1��
��2��ijͬѧȡ100 mL ����84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c(Na��)��________ mol��L��1��
��3����ͬѧ���ĸ���84����Һ�����䷽������NaClO��������480 mL��NaClO��������Ϊ25%������Һ������˵����ȷ����________(����ĸ)��
A����ͼ��ʾ�������У��������Dz���Ҫ�ģ�����Ҫһ�ֲ�������
B������ƿ������ˮϴ����Ӧ��ɺ����������Һ����
C�����ƹ����У�δ������ˮϴ���ձ��Ͳ��������ܵ��½��ƫ��
D����Ҫ����NaClO���������Ϊ143.0 g
��4����84����Һ����ϡ������ʹ�ÿ���ǿ����������ij����С����Ա��98%(�ܶ�Ϊ1.84 g��cm��3)��Ũ��������2 000 mL 2.3 mol��L��1��ϡ����������ǿ��84����Һ��������������
�������Ƶ�ϡ�����У�H�������ʵ���Ũ��Ϊ________ mol��L��1��
������Ũ��������Ϊ________ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�����ⶨ������(25 ����101 kPa)������Ħ���������ش��������⡣
��С����Ƶļ���ʵ��װ����ͼ��ʾ��
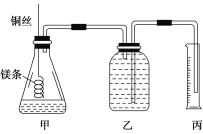
��ʵ�����Ҫ�����������£�
������100 mL 1.0 mol/L��������Һ��
����________(���������Ʋ�ע�����)��ȡ10.0 mL 1.0 mol/L��������Һ������ƿ�У�
����ȡa g�ѳ�ȥ��������Ĥ��þ������ϵ��ͭ˿ĩ�ˣ�ΪʹHClȫ���μӷ�Ӧ��a����ֵ����Ϊ________��
�������ƿ��װ������ˮ������ͼ���Ӻ�װ�ã����װ�õ������ԣ�
����Ӧ���������ϵ�¶Ȼָ������£�������Ͳ��ˮ�����ΪV mL��
�뽫�������貹���������ش��������⡣
(1)�����ֱ���ʵ�鲽�����м��װ�������Եķ�����
___________________________________________________
(2)ʵ�鲽������Ӧѡ��________(�����)����Ͳ��
A��100 mol����������B��200 mL����������C��500 mL
����ʱ���ָ��������⣬��Ҫע��_________________________________________��
(3)������ˮ������Ӱ�죬��ʵ�������²������Ħ������ļ���ʽΪVm��________����δ��ȥþ�����������Ĥ����������________(����ƫ��������ƫС��������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO 4)��һ�����͡���Ч�����ˮ�����������з�Ӧ����ȡK2FeO4��2Fe(OH)3+3Cl2+10KOH��2K2FeO4+6��+8H2O������˵������ȷ����
A. ÿת��1mole�������Եõ�33g K2FeO4
B. ����������ӦΪKCl
C. �÷�Ӧ����Ԫ�صĻ��ϼ�����
D. �����ԣ�Cl2��K2FeO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ���ɻ�ȡCO�������й�˵����ȷ����
��ľ̿����ȫȼ����CO��2C(s)+O2(g)=2CO(g) ��H1����221kJ��mol��1
��ľ̿��ԭCO2��CO��C(s) +CO2(g)��2CO(g) ��H 2 ��+172.5 kJ��mol��1
�۽�̿��ԭFe2O3��CO��Fe2O3(s) + 3C(s) ![]() 2Fe(s) + 3CO(g) ��H 3��+489.0kJ��mol��1
2Fe(s) + 3CO(g) ��H 3��+489.0kJ��mol��1
A. ��Ӧ���л�ѧ��ȫ��ת��Ϊ����
B. ��Ӧ��Ϊ���ȷ�Ӧ�����κ�����¶������Է�����
C. ��Ӧ����ʹ�ô��������߲���CO���������Fe2O3��ת����
D. ��ӦFe2O3(s)+ 3CO(g)��2Fe(s)+ 3CO2(g) ��H ����28.5 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Al2(SO4)3��MgSO4�Ļ����Һ�У��μ�NaOH��Һ�����ɳ������������NaOH��Һ�������ϵ����ͼ��ʾ����ԭ���Һ��Al2(SO4)3��MgSO4�����ʵ���Ũ��֮��Ϊ( )

A. 6��1 B. 3��1 C. 2��1 D. 1��2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com