
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1451.6 kJ/mol | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6 kJ/mol |
分析 0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,64g甲醇即2mol甲醇燃烧放的热量为1451.6kJ,根据热化学方程式的书写方法来回答.
解答 解:A、0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);△H=-725.8 kJ•mol-1,故A正确;
B、2CH3OH(l)+3O2(g)=2 CO2(g)+4H2O(l)△H=-1451.6 kJ•mol-1,水是液态,故B错误;
C、反应吸热时焓变值为正值,放热时焓变值为负值,甲醇燃烧是放热反应,故△H<0,故C错误;
D、0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则64g甲醇即2mol甲醇燃烧放的热量为1451.6kJ,根据热化学方程式的书写方法写出为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),水是液态,△H=-1451.6kJ/mol,故D正确;
故选AD.
点评 本题主要考查学生热化学方程式的书写方法及系数的含义,注意焓变的正负和单位问题,该题型是考试的热点.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
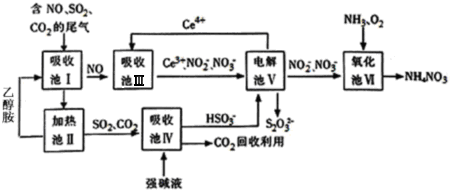
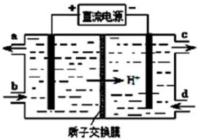
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
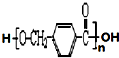
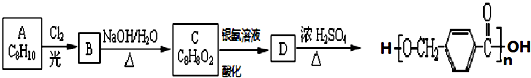
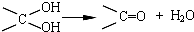
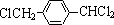 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.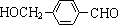 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$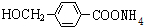 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n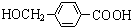 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$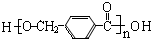 +(n-1)H2O
+(n-1)H2O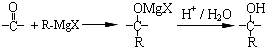
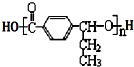 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3═2H++CO32- | B. | NaClO═Na++Cl-+O2- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaOH═Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
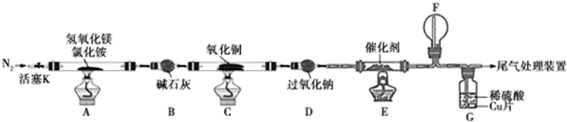
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
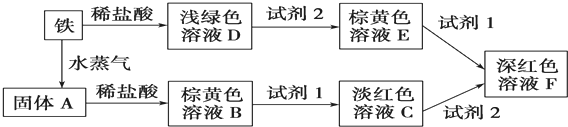
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com