
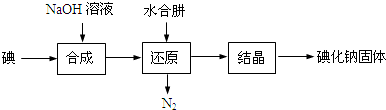
分析 合成过程的反应产物中含有IO3-,发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)根据发生的反应改写为离子方程式;
(2)N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质;
(3)加入淀粉溶液,加盐酸酸化,若含有IO3-,会与I-反应生成I2,淀粉遇碘变蓝色;
(4)①稀溶液溶液呈酸性,应放在酸式滴定管中;重复操作,减少实验误差;
②部分NaI被空气中O2氧化.
解答 解:合成过程的反应产物中含有IO3-,发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,离子方程式为3I2+6OH-=5I-+IO3-+3H2O,故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(2)N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高,
故答案为:N2H4•H2O的氧化产物为N2和H2O;
(3)检验还原液中是否含有IO3-的实验方案:取适量还原液,加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-,
故答案为:加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-;
(4)①稀溶液溶液呈酸性,应放在酸式滴定管中;重复操作,减少实验误差,
故答案为:酸式滴定管;减少实验误差;
②部分NaI被空气中O2氧化,导致滴定消耗硝酸银溶液偏小,测定产品中的NaI含量偏低,故答案为:部分NaI被空气中O2氧化.
点评 本题考查物质制备实验,明确制备流程中发生的反应是解题关键,注意对题目信息的提取应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
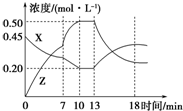 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )| A. | 第7 min时升高温度、第13 min时降低温度 | |
| B. | 第7 min时使用催化剂、第13 min时升高温度 | |
| C. | 第7 min时降低温度、第13 min时增大压强 | |
| D. | 第7 min时减小压强、第13 min时升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、H+、Cl- | B. | Cl-、CO32-、OH- | C. | K+、OH-、CO32- | D. | K+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | Fe和FeCl3 | C. | Na2CO3和HCl | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com