
| A、利用化学平衡常数判断化学反应进行的快慢 |
| B、利用溶解度数据判断氧化还原反应发生的可能性 |
| C、利用沸点数据推测将一些液体混合物分离的可能性 |
| D、利用物质的摩尔质量判断相同状态下不同物质密度的大小 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 物 质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| A、该反应是吸热反应 |
| B、该反应的平衡常数随温度的升高而增大 |
| C、压强升高时平衡常数也随之增大 |
| D、该反应的平衡常数随温度的升高而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑ |
| C、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、FeCl2酸性溶液放在空气中变质:4Fe2++4H++O2=4Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于优质合金材料 |
| B、将少量CO2通入CaCl2溶液能生成白色沉淀 |
| C、蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
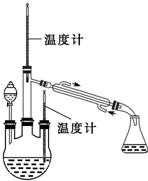 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| C、0.1mol/LNaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) |
| D、室温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
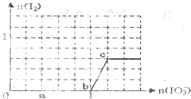 已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO3 |
| B、a点时剩余NaHSO3的物质的量为1.2 mol |
| C、b点时的还原产物可能是KI或NaI |
| D、当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V(NaOH) | V(KHP)平均 |
| 20.00mL | 18.00mL |
| V(稀释后的醋) | V(NaOH)平均 |
| 18.00mL | 20.00mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com