
| A. |  | B. |  | ||
| C. |  | D. |  |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 240 mL 0.2 mol•L-1的NaOH溶液配制:需要使用天平、烧杯、250 mL容量瓶等仪器 | |
| B. | 除去Cu粉中的CuO,可向混合物中滴加适量稀硫酸再过滤 | |
| C. | 为增强氯水的漂白性,向其中加入碳酸钙 | |
| D. | 为使0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50克水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片表面有气泡生成,且铜片为正极,为电子流入的一极 | |
| B. | 如果将硫酸换成苹果汁,导线中不会有电子流动 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将锌片换成铁片,电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
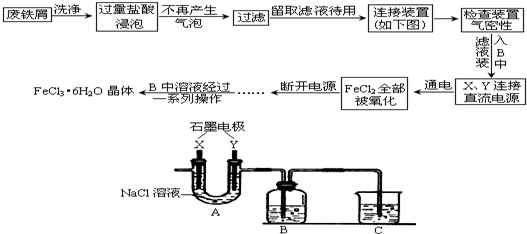
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2 NA | |
| D. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com