
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定分析 Ⅰ、(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,应生成1mol液态水;
(2)A.实验装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;
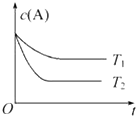
Ⅱ、(3)温度越高达平衡所需的时间越短,然后结合图象分析反应的热效应,从而得出K的变化情况;
(4)根据三行式,结合平衡常数和反应速率的公式来求解.
解答 解:Ⅰ、(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,应生成1mol液态水,热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)A、实验装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.用量筒量取盐酸时俯视读数,会导致所量的盐酸体积偏小,放出的热量偏低,中和热的数值偏小,故B正确;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故C正确;
故选:ABC;
Ⅱ、(3)由图可知T2先达平衡状态,所以T1小于T2,而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,故答案为:小于;小于;
(4)A(g)?B(g)+C(g)
起始浓度:0.050 0 0
变化浓度:0.03 0.03 0.03
平衡浓度:0.02 0.03 0.03
①平衡时体系总的物质的量为=(0.02+0.03+0.03)×1=0.08mol;
②K=$\frac{0.03×0.03}{0.02}$=0.045mol/L;
③反应在0~2min区间的平均反应速率v(A)=$\frac{0.03mol/L}{2min}$=0.015mol/(L•min);
故答案为:0.08mol;0.045mol/L;0.015mol/(L.min).
点评 本题考查热化学方程式以及反应热的测定化学反应能量变化,化学平衡影响因素的分析判断,图象分析与化学平衡的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:填空题
化学学习中要注意对过程的分析,按要求回答下列问题:
(1)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是 、 。
(2)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式 ;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的△H也随之改变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3(Al2O3)用盐酸 | B. | Fe2O3(Al2O3)用氨水 | ||
| C. | Mg(Al)用纯碱溶液 | D. | MgCl2(AlCl3)用氢氧化钠溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
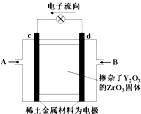 如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )| A. | c电极名称为负极,气体A为空气 | |
| B. | d电极上发生反应:CH4-8e-+4O2-═CO2+2H2O | |
| C. | O2-向c电极移动 | |
| D. | 用此装置作电源电解精炼铜,d电极与粗铜相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
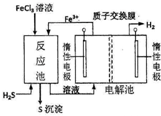 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
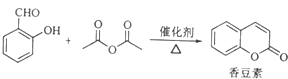
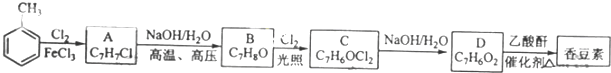
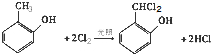 ;
;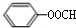 (写结构简式)
(写结构简式)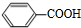 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO2量不变 | C. | 氧气压强不变 | D. | BaO量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com