
| A. | H2O2具有氧化性,在反应中只做氧化剂 | |
| B. | 1735Cl、1737Cl为不同的核素,但化学性质几乎完全相同 | |
| C. | 实验室用加热NH4Cl固体的方法来制备NH3 | |
| D. | 1.12L Cl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
分析 A.H2O2具有强氧化性,但分解时既作氧化剂又作还原剂;
B.同位素化学性质相同;
C.加热NH4Cl固体生成氨气和氯化氢,但在温度降低时,氨气和氯化氢又会重新化合生成NH4Cl固体;
D.温度和压强不同,气体摩尔体积不同,无法计算氯气的物质的量.
解答 解:A.H2O2中O元素化合价是-1价,所以H2O2具有强氧化性,但分解时生成水和氧气,既作氧化剂又作还原剂,故A错误;
B.这两种原子属于同位素,同位素的核外电子数及电子排布相同,所以同位素化学性质相同,故B正确;
C.加热NH4Cl固体生成氨气和氯化氢,但在温度降低时,氨气和氯化氢又会重新化合生成NH4Cl固体,所以实验室不能用加热NH4Cl固体的方法来制备NH3,应用氯化铵和氢氧化钙混合加热制备,故C错误;
D.温度和压强未知,所以气体摩尔体积未知,导致无法计算气体的物质的量,所以无法计算含有质子数,故D错误;
故选B.
点评 本题考查了H2O2的性质、同位素以及氨气的制备等知识点,易错选项是D,有关气体体积的计算要注意温度和压强,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
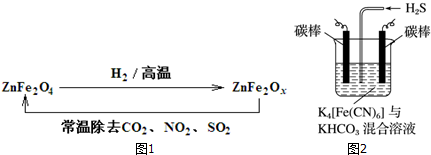
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
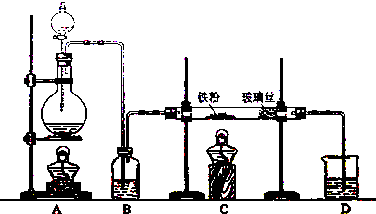
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加KNO3的次数 | 1 | 2 | 3 | 4 |
| 加KNO3的质量(g) | 15 | 30 | 45 | 60 |
| 所得溶液质量(g) | 115 | 130 | 145 | 145 |
| A. | 该温度下KNO3的溶解度为45g | |
| B. | 第2次加入KNO3后所得溶液为不饱和溶液 | |
| C. | KNO3属于易溶的盐 | |
| D. | 第4次加入KNO3后所得溶液的质量分数为45% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的Cu2+、Ag+、H+的溶液中加入铁粉直至过量:Cu2+、Ag+、H+ | |
| B. | 在含Al3+、H+、NH4+的溶液中逐渐加入过量烧碱溶液:H+、NH4+、Al3+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2至过量:KOH、Ba(OH)2 | |
| D. | 在含I-、Br-、Fe2+的溶液中通入过量Cl2:I-、Fe2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:
云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是NA | |
| B. | 常温常压下,4g氦气所含有的原子数目为NA | |
| C. | 标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4、N2等均是造成“温室效应”的气体 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 节能减排符合“低碳经济”的要求 | |
| D. | 合理开发利用“可燃冰”(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com