
 以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
 以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
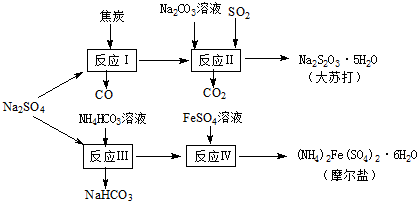
(13分)以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下:
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)= Na2S (s)+4CO(g)△H=+569.99kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(a)常温 (b)常温,并通入少量CO2 (c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式:□Na2S+□Na2CO3+□SO2=□Na2S2O3+□CO2
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO都大量减少,该物质是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏省高二上学期开学考试化学试卷 题型:实验题
(13分)以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下:
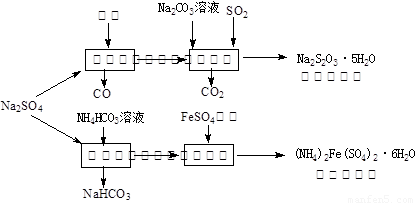
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)= Na2S (s)+4CO(g)△H=+569.99 kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(a)常温 (b)常温,并通入少量CO2 (c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式: □Na2S+□Na2CO3+□SO2 =□Na2S2O3+□CO2
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO 都大量减少,该物质是 。
都大量减少,该物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料w*w^w.k&s#5@u.c~o*m的综合利用率较高。其主要流程如下:

试回答下列问题:w ww.k s5u. co m
(1)已知反应Ⅰ中有Na2S生成,该反应的化学方程式为 ▲ 。
(2)配平反应Ⅱ的化学方程式: □Na2S+□Na2CO3+□SO2 =□Na2S2O3+□CO2
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是 ▲ 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO![]() 都大量减少,该物质
都大量减少,该物质
是 ▲ 。
(5)反应Ⅳ后,一般在酸性条件下结晶出摩尔盐,但如果该操作时间过长,摩尔盐中会因氧化而混有杂质,用离子方程式说明原因 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com