

 ;(提示:反应过程中无碘单质生成;Cu 做催化剂)
;(提示:反应过程中无碘单质生成;Cu 做催化剂) ;
; )为主要有机原料(无机原料任选),写出合成己二酸的合成线路:
)为主要有机原料(无机原料任选),写出合成己二酸的合成线路: .
. 分析 (1)炔烃可以和Br2以1:2完全加成,再结合系统命名法给加成产物命名即可;
(2)根据C的结构简式并结合常见官能团的结构判断所含官能团;
(3)根据B和C及F和E的结构简式判断B→C及E→F发生的反应类型;
(4)D在Cu催化的作用下与CH2I2发生加成反应生成E,结合原子守恒写出D→E的化学方程式;
(5)E 与F 混合后,在浓硫酸催化作用下发生酯化反应,结合原子守恒可写出酯化反应的化学方程式;
(6)①能使溴的四氯化碳溶液褪色;说明含有不饱和键如碳碳双键;②属于二取代苯,其中一个取代基为羧基且与苯环直接相连,另一个取代基上无支链,这两个取代基应该有邻、间及对位三种情况,由此判断出符合条件F的同分异构体种类;
(7)用乙炔和环氧乙烷为原料制己二酸时可以用乙炔和环氧乙烷发生类似B→C的反应,所得产物再依次与氢气完全加成后催化氧化即可得到目标产物.
解答 解:(1)乙炔与Br2完全加成的产物为CHBr2CHBr2,根据系统命名法此产物为1,1,2,2-四溴乙烷,故答案为:1,1,2,2-四溴乙烷;
(2)C的结构简式为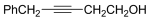 ,含有的官能团为羟基和碳碳叁键,故答案为:羟基、碳碳叁键;
,含有的官能团为羟基和碳碳叁键,故答案为:羟基、碳碳叁键;
(3)由B和C的结构简式可知B→C发生了加成反应,由E和F的结构简式可知E→F发生了氧化反应,故答案为:加成反应;氧化反应;
(4)在Cu作催化剂的作用下,由D→E 的化学反应方程式为 ,故答案为:
,故答案为: ;
;
(5)E 与F 混合后,在浓硫酸催化作用下发生酯化反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(6)①能使溴的四氯化碳溶液褪色;说明含有不饱和键如碳碳双键;②属于二取代苯,其中一个取代基为羧基且与苯环直接相连,另一个取代基上无支链,则除-COOH外,另一个无支链的取代基可能是-CH=CH2CH2CH2CH3、-CH2CH=CHCH2CH3、-CH2CH2CH=CHCH3、-CH2CH2CH2CH=CH2共4种,再结合有邻、间及对位三种情况,可知符合条件的F的同分异构体种类是12种,故答案为:12;
(7)用乙炔和环氧乙烷为原料制己二酸时的合成路线为 ,
,
故答案为: .
.
点评 本题考查有机推断与合成,涉及多官能团有机物性质的判断及有条件同分异构体的书写,难点是设计合成路线以特定原料合成目标产物,综合性较强,中等难度,要求学生要有扎实的基本功和应用新知识解决问题的能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:多选题
 去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性AgCl>AgBr>Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,用0.2mol•L-1的NaOH浓溶液滴定10.00mL0.2mol•L-1一元酸HA浓液,溶液的温度和pH随加入NaOH溶液体积(V)的变化曲线如图所示.下列有关说法不正确的是( )
室温下,用0.2mol•L-1的NaOH浓溶液滴定10.00mL0.2mol•L-1一元酸HA浓液,溶液的温度和pH随加入NaOH溶液体积(V)的变化曲线如图所示.下列有关说法不正确的是( )| A. | HA是弱酸 | |
| B. | c点水的离子积最大 | |
| C. | c点后温度降低主要原因是NaA水解吸热 | |
| D. | 在a、b点之间(不包括b点)一定有c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮氧化物和碳氧化合物的综合治理是当前的重要课题之一.
氮氧化物和碳氧化合物的综合治理是当前的重要课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请将步骤补齐:
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请将步骤补齐:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )| A. | b电极是负极 | |
| B. | 装置中的离子交换膜是阳离子交换膜 | |
| C. | 阳极电极反应:4OH--4e-═2H2O+O2↑ | |
| D. | a极区的KI最终转变为KIO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com