
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙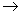 丁+己,甲+丙
丁+己,甲+丙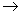 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
A.元素X在周期表中的位置为第2周期ⅥA族
B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X)
C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023
D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
如右图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、
C分别为四个电极,当闭合开关后,则以下叙述正确的是
A.C电极为电解池的阳极
B.Cu电极附近OH—浓度增大
C.Na+移向Pt电极
D.Pt电极上有O2生成

查看答案和解析>>
科目:高中化学 来源: 题型:
(化学——选修有机化学基础)(15分)
研究表明,火灾中,真正烧死的人其实并不多,大多数人都是因慌乱奔跑时吸入大量浓烟,导致烟雾中毒而死的。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯(PVC)是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

请回答下列问题:
⑴火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,①~③的反应类型是 。
在火灾现场,为防止气体中毒的防护措施是 。
⑵工业上用乙烯和氯气为原料经下列各步合成PVC:
 |  |  |
乙烯 甲 乙 PVC
乙是PVC的单体,其结构简式为 ,反应①、②的化学方程式分别为 、 。
⑶聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标
准的增塑剂DEHA。 邻苯二甲酸辛酯(DOP)是国家标准中允许使用的
邻苯二甲酸辛酯(DOP)是国家标准中允许使用的
增塑剂之一,邻苯二甲酸酐( )是制造DOP的原料,它跟过
量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备1,2-二溴乙烷的反应原理如下:
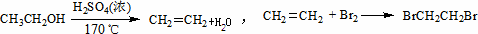
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)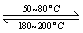 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+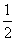 O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时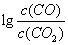 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
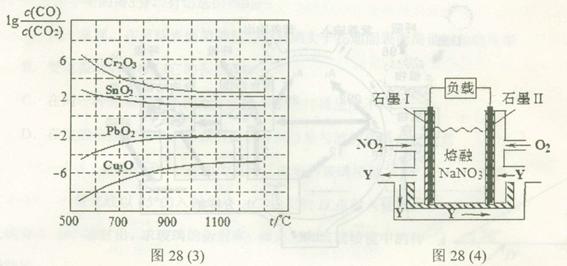
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
有两种气态烃组成的混合气体完全燃烧后所得到的CO2和H2O的物质的量随混合烃的总物质的量的变化如右图所示,则下列对混合烃的判断正确的是 ( )

①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷
A、①②⑤ B、②⑤ C、②④ D、②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com