
| A. | 5.4g | B. | 7.2g | C. | 8.1g | D. | 10.8g |
分析 根据铝的质量相同,硫酸和氢氧化钠溶液中溶质的物质的量相同,应结束后测得生成的气体体积比为甲:乙=2:3,由化学反应方程式2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸与金属反应时酸不过量,碱与金属反应时碱过量,以此来计算解答.
解答 解:硫酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,又两烧杯中分别加入等质最的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6H+═2Al3++3H2↑
6 3
0.6mol x
解得x=0.3mol,
一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.3mol×$\frac{3}{2}$=0.45mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.45mol
解得y=$\frac{2×0.45mol}{3}$=0.3mol,
则铝的质量为0.3mol×27g/mol=8.1g,
故选C.
点评 本题考查Al的化学性质及利用化学反应方程式的计算,把握铝与酸、碱反应水的化学反应方程式,酸碱足量、酸碱均不足量时得到的氢气的关系是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 与金属镁反应时,氯得到一个电子而硫得到2个电子 | |
| B. | 铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁 | |
| C. | 氯的最高价为+7,硫的最高价为+6 | |
| D. | HClO比H2SO4氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .写出三种属于芳香烃类的A的同分异构体
.写出三种属于芳香烃类的A的同分异构体 、
、 、
、 .(不包括A,写结构简式)
.(不包括A,写结构简式) +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应类型是氧化反应.C→E反应的化学方程是
+2H2O;反应类型是氧化反应.C→E反应的化学方程是 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl;
+NaCl; ;反应类型是氧化反应.
;反应类型是氧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素处于最高价态,一定具有最强的氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 还原剂失电子越多,还原性越强 | |
| D. | 在化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
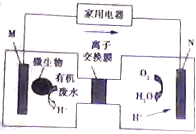 有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机物废水的化学能直接转化为电能,该装置的构造如图所示.下列说法中正确的是( )
有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机物废水的化学能直接转化为电能,该装置的构造如图所示.下列说法中正确的是( )| A. | 装置外电路中箭头的方向代表电流的方向 | |
| B. | 该装置为原电池,其中N为负极 | |
| C. | 标准状况下,N电极每消耗11.2L气体时会有4NA离子通过离子交换膜 | |
| D. | 若有机废水中含有葡萄糖,则M电极发生的电极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 | |
| B. | 绿色食品就是不使用化肥农药,不含任何化学物质的食品 | |
| C. | 光催化水制氢比电解水制氢更节能环保 | |
| D. | 光化学烟雾不会引起呼吸道疾病 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>b | B. | 原子半径X<W | ||
| C. | 离子半径Y2-<Z- | D. | 离子的氧化性W3+>X+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图1:
以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图1:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com