
| A. | 氢氧化钠晶体 | B. | 硫酸亚铁晶体 | C. | 浓硫酸 | D. | 浓盐酸 |
分析 A.NaOH溶液易与空气中二氧化碳反应变质;
B.硫酸亚铁中二价铁离子易被空气中的氧气氧化,发生氧化还原反应;
C.浓硫酸具有吸水性;
D.浓盐酸易挥发,放在敞口容器中浓度变稀.
解答 解:A.NaOH溶液能与二氧化碳反应,则不能长期存放在敞口容器中,但不与氧气发生氧化反应,故A错误;
B.硫酸亚铁中亚铁离子具有还原性,易被空气中的氧气氧化而不能长期存放在敞口容器中,故B正确;
C.浓硫酸具有吸水性,但不与氧气发生氧化还原反应,故C错误;
D.浓盐酸易挥发,放在敞口容器中溶质减少,浓度变稀,但不与氧气发生氧化还原反应,故D错误.
故选B.
点评 本题以试剂的保存考查氧化还原反应,明确物质的性质是解答本题的关键,注意具有还原性的试剂应隔绝氧气保存,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
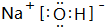 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO5•5H2O的质量 | |
| B. | 纯水在25℃和90℃时的pH值 | |
| C. | 25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 | |
| D. | 在反应NH3+NO→N2+H2O中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$、K+ | B. | K+、Cl-、Na+、SO${\;}_{4}^{2-}$ | ||
| C. | Mg2+、NO${\;}_{3}^{-}$、K+、Cl- | D. | Na+、Ba2+、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
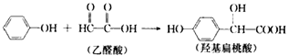
| A. | 该反应是加成反应 | |
| B. | 1 mol羟基扁桃酸能与3mol NaOH反应 | |
| C. | 乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物 | |
| D. | 苯酚和羟基扁桃酸遇上FeCl3溶液都会显色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的单质能够用来制造光导纤维 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A. | 金属晶体的熔点不一定比分子晶体的高 | |
| B. | 表中共价化合物分子的所有原子都形成了8电子结构 | |
| C. | 同族元素的氧化物形成的晶体类型一定相同 | |
| D. | AlF3、AlCl3、BCl3都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3价 | B. | +6价 | C. | +4价 | D. | +5价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com