
����Ŀ����.�������м������ʣ������� ��ʯī �۾ƾ� ��SO2 ������KHSO4 ��Ba(OH)2���� �߰�ˮ������
��1������ǿ����ʵ���_____________�����ڷǵ���ʵ���_____________��������ţ�
��2�����ͭ��һ�������¿ɷ������·�Ӧ��3Cu+8HNO3��ϡ��=3Cu(NO3)2+2NO��+4H2O�����Խ����������������ʵ���֮��Ϊ________������˫���ŷ���������ת�Ʒ������Ŀ_______��
��.��Ba(OH)2��Һ����μ���ϡ���ᣬ������������⣺
��1��д����Ӧ�����ӷ���ʽ__________________________________________________ ��
��2��������������£����ӷ���ʽ�루1����ͬ����______������ĸ����
A.��NaHSO4��Һ�У���μ���Ba(OH)2��Һ����Һ������
B.��NaHSO4��Һ�У���μ���Ba(OH)2��Һ��SO42-ǡ����ȫ����
C.��NaHSO4��Һ�У���μ���Ba(OH)2��Һ������
��3������������ϡ���������������������л����Һ�ĵ����������õ���ǿ��I��ʾ���ɽ��Ƶ�����ͼ�е�______���߱�ʾ������ĸ����

���𰸡��ݢޢ� �ۢ� 3:1 �� Ba2++2OH-+2H++SO42-=BaSO4��+2H2O A C
��������
I.(1) ��ˮ��Һ�л�����״̬���ܵ���Ļ�����Ϊ����ʣ��ܹ���ȫ���������ǿ����ʣ���ˮ��Һ�к�����״̬�¾����ܵ���Ļ�����Ϊ�ǵ���ʣ����������ڻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���ʯī���ڵ��ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ��۾ƾ����ڷǵ���ʣ� ��SO2�Ƿǵ���ʣ� ������KHSO4��ǿ����ʣ� ��Ba(OH)2������ǿ����ʣ� �߰�ˮ���ڻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���������ǿ�ᣬ��ǿ����ʣ��ʴ�Ϊ���ݢޢ��� �ۢܣ�
(2) 3Cu+8HNO3��ϡ��=3Cu(NO3)2+2NO��+4H2O��8mol������2mol����ԭ��6mol�������ԣ������Խ����������������ʵ���֮��Ϊ3:1����˫���ŷ���ʾΪ��

II.(1) Ba(OH)2��Һ����μ���ϡ��������ǿ����ǿ�Ӧ�����ɵ����ᱵ�������ܲ����ӷ���ʽΪ��Ba2++2OH-+2H++SO42-=BaSO4��+2H2O��
(2) ��NaHSO4��Һ�У���μ���Ba��OH��2��Һ����Һ�����ԣ�Ba2++2OH-+2H++SO42-=BaSO4��+2H2O����A��ȷ��
B����NaHSO4��Һ�У���μ���Ba��OH��2��Һ��SO42-ǡ����ȫ������Ba2++OH-+H++SO42-=BaSO4��+H2O����B����
C����NaHSO4��Һ�У���μ���Ba��OH��2��Һ��������Ba2++OH-+H++SO42-=BaSO4��+H2O����C����
�ʴ�Ϊ��A��
(3) ����ϡ����ֱ��������ǡ�÷�Ӧʱ������Ϊ0������������Ũ������������ǿ��ͼ��ֻ��C���ϣ��ʴ�Ϊ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ý���ʵ�飬�����������ƶϳ����۵��ǣ� ��
ѡ�� | �Լ�X | Y���Լ������� | ���� | װ�� |
A | һ���� | ��̪��Һδ��� | ���β���������� |
|
B | С�մ�ʹ��� | ʯ��ˮ����� | �����С�մ��ȶ� | |
C | �����������Ȼ�� | ��������Һ���Ȳ����������ܽ� | Ag2O�����ڰ�ˮ | |
D | �������������� | ���ۡ��⻯�غͺ�����Ļ����Һ���� | ��Ӧ������Cl2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯӢɰ�ң��ǹ�ʯ�е�һ�֣�����Ҫ��ѧ�ɷֿɼ�ʾΪMgAl4Si10O26(OH)2(�������ʾ�����������)����ҵ�����ø�����Ϊԭ���Ʊ��ߴ��ȹ裬����������ͼ��ʾ��
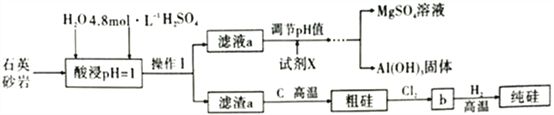
��1���뽫ʯӢɰ�ҵ���������������ʽ��ʾ��________________,���ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��______________________________________��(�������)
��2��ʵ������18.4mol��L-1��Ũ��������250mL4.8mol��L-1�����ᣬ����ȡŨ����_______mL(�������һλС��)������ʱ���ò�����������Ͳ���ձ��Ͳ������⣬����__________________________��
��3���Ʊ��ߴ���Ĺ�������Ҫ�õ�Cl2����д��ʵ�����Ʊ�Cl2�����ӷ�Ӧ����ʽ��______________��
��4����д��b��H2��Ӧ�Ļ�ѧ����ʽ�����õ����ŷ���ʾ�÷�Ӧ�����е��ӵ�ת�ƣ�_______________��
��5��ͨ��ʵ������Һa��c(Al3+)=1.0mol��L-1��c(Mg2+)=0.28mol��L-1��ijͬѧ����ͨ��������Һ��pHֵʹAl3+��Mg2+��ȫ����(������Ũ�Ƚ���1.0��10-6mol��L-1ʱ����Ϊ��ȫ����)�����Լ�X��_______(����0.1mol��L-1NaOH����0.1mol��L-1��ˮ��)�Ϻ�������ʱӦ������Һ��pHֵ��ȡֵ��ΧΪ_______(��֪��KspAl(OH)3=8.0��10-33��Ksp[Mg(OH)2]=2.8��10-11��lg2=0.3��lg5=0.7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ᷴӦ����������������Һ��Ӧ��������
A. Cu B. Fe2O3 C. AlCl3 D. Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300 ��ʱ����2 mol SO2��1 mol O2�����2 L�ĺ����ܱ���������������Ӧ2SO2(g) + O2(g) ![]() 2SO3(g)����H��2 minĩ�ﵽƽ�������SO2��ת����Ϊ60%������ݻ�ѧ��Ӧ���й�ԭ���ش�����������
2SO3(g)����H��2 minĩ�ﵽƽ�������SO2��ת����Ϊ60%������ݻ�ѧ��Ӧ���й�ԭ���ش�����������
��1����֤����Ӧ�Ѿ��ﵽƽ��״̬����________��
�� c(SO2)��c(O2)��c(SO3) = 2��1��2
����λʱ��������n mol SO3��ͬʱ����n mol SO2
����Ӧ����v(SO3) = 2v(O2)
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯
��2����ͼ��ʾ�÷�Ӧ������(v)��ʱ��(t)�仯�Ĺ�ϵ:
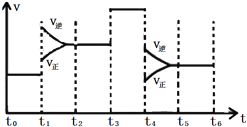
��ͼ������t3ʱ�ı���������������________��t6ʱ���������������ϵ�г�������He��ƽ��________(��������������������������)�ƶ���SO2������ߵ�������______(����t0~t1������t2~t3������t3~t4������t5~t6��)��
��3��300 ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ________���������¶ȸ÷�Ӧ��ƽ�ⳣ����С������H___0(��������������С����������ȷ����)��
��4���������ͬ��������������Ӧ���淴Ӧ����ʼ��������ʼʱ����SO2 0.6 mol��SO3 1.4 mol����ʹƽ��ʱ�����ʵ���Ũ����ԭ��ƽ����ͬ����Ӧ����O2________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ���á�84����Һ��ͨ��ϡ��100��(���֮��)��ʹ�á���ش��������⣺

��1���á�84����Һ�������ʵ���Ũ��ԼΪ__mol��L-1 ������1λС������
��2��ijͬѧȡ100mL�á�84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c(ClO-)_________mol��L-1(������ClO-��ˮ��)��
��3����ͬѧ���ĸá�84����Һ�����䷽������NaClO��������480mL��NaClO��������Ϊ25%������Һ������˵������ȷ����________������ĸ����
A������ͼ��ʾ�������У��������Dz���Ҫ�ģ�������Ҫһ�ֲ�������
B���������õ�NaClO�������ձ����ܽ��Ӧ����ת������ƿ
C������ʱ��������ƿ�̶��ᵼ��������ҺŨ��ƫ��
D����Ҫ����NaClO���������Ϊ149.0g
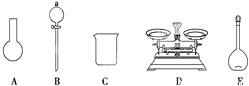
��4����ͬѧ������ƿ����ʹ�÷�������ʶ����ȷ����_______������ĸ����
A.����ƿ�ϱ����ݻ����¶Ⱥ�Ũ��
B.ʹ��ǰҪ�������ƿ�Ƿ�©Һ
C.����ƿ������ˮϴ�������ɺ���ʹ��
D.������Һ�����У�����ƿ��Һ��ֻ��Ҫһ��ҡ�ȹ���
��5����84����Һ����ϡ������ʹ�ÿ���ǿ����������ij����С����Ա��18.4mol��L-1 ��Ũ��������2L2.3molL��1��ϡ����������ǿ��84����Һ������������������Ũ��������Ϊ_____mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaCl2��NaCl�Ļ����ҺVL�������ֳ����ȷݡ�һ�ݵμ�ϡ���ᣬʹBa2+��ȫ��������һ�ݵμ�AgNO3��Һ��ʹCl-��ȫ��������Ӧ������amolH2SO4��bmolAgNO3����ԭ�����Һ�е�c(Na+)Ϊ
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ���ⶨ�����Ũ����ʵ�����н���ʵ�顣�����������գ�
��1������100ml0.10molL1NaOH����Һ�����������_____g�������ƹ��塣
��2��ȡ20.00mL����������Һ������ƿ�У����μ�23�η�̪��ָʾ�������Լ����Ƶı�ҺNaOH��Һ���еζ����ظ������ζ�����23�Σ���¼�������£�
ʵ���� | NaOH��Һ��Ũ�� | �ζ����ʱ��NaOH��Һ��������/mL | ������������/mL |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
�ٵζ��ﵽ�յ�ı�־��____________________________________________.
�ڸ��������������ɼ�����������Ũ��ԼΪ__________(������λ��Ч����).
����ȥ��ʽ�ζ��������ݵķ���Ӧ������ͼ��ʾ�����е�________��Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��

��������ʵ���������в���(����������ȷ)����ɲⶨ���ƫ�ߵ��У�___________
A. �ζ��յ����ʱ���Ӷ���
B. ��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������Һ��ϴ
C. ��ƿˮϴ��δ����
D. ����NaOH�������Na2CO3����
E. ���ƺõ�NaOH����Һ���治��������������е�CO2��Ӧ������Na2CO3
F. ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com