
| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
分析 A.量筒精确到0.1mL;
B.托盘天平精确到0.1g;
C.容量瓶的规格和所配制的溶液的体积进行选择分析;
D.广泛pH试纸的精确度只能达到整数.
解答 解:A、量筒量取时能精确到0.1mL,无法量取12.36ml盐酸,故A错误;
B、天平可精确到0.1g,不能用托盘天平称取8.75g氯化钠,故B错误;
C、容量瓶的规格和所配制的溶液的体积相符,可配制500mL0.2 mol/L盐酸溶液,故C正确;
D、广泛pH试纸测得溶液的pH值应是整数,无法测得某溶液的pH为2.5,故D错误.
故选C.
点评 本题考查中学化学中常用仪器在使用中读数的问题,容量瓶的使用方法,熟悉不同仪器的精确度不同,只要熟练掌握基本知识便可解决,题目难度不大,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
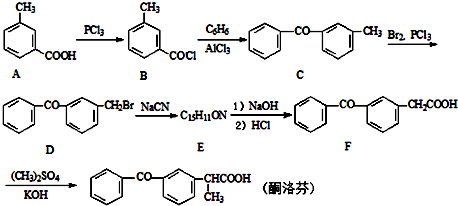
 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.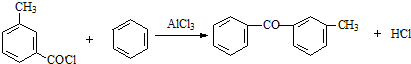 .
. .
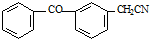
. 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH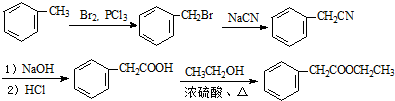 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
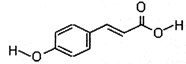
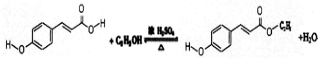 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
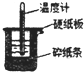 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
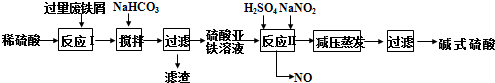
 [Fe2(OH)4]2++2H+.
[Fe2(OH)4]2++2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
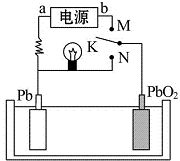
| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO42-、CO32-、K+ | B. | Na+、Ba2+、Ca2+、HCO3- | ||
| C. | Mg2+、Ag+、K+、Cl- | D. | K+、Cl-、Na+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com