
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中滴加NaOH溶液,产生白色沉淀 | 该溶液中一定含有Al3+ |
| C | 向某溶液中加人NaOH浓溶液,加热,产生的气体能使湿润的 红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| D | 向某紫红色溶液中加人过量Na2SO3溶液,溶液紫红色褪去 | 该溶液中一定含有MnO4- |
| A. | A | B. | B | C. | C | D. | D |
分析 A、能够与氯化钡反应生成不溶于盐酸的沉淀的离子可能为银离子、SO42-离子;
B、向某溶液中滴加NaOH溶液,产生白色沉淀,白色沉淀可以是氢氧化铝、氢氧化镁、氢氧化锌等;
C、使湿润的红色石蕊试纸变蓝的气体为氨气,溶液中一定存在铵离子;
D、某紫红色溶液中加人过量Na2SO3溶液,溶液紫红色褪去,说明紫红色溶液具有氧化性,可以是含有碘单质或是高锰酸钾的溶液.
解答 解:A、向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,白色沉淀可能为氯化银、硫酸钡,原溶液中可能存在硫酸根离子、银离子,所以不一定含有硫酸根离子,故A错误;
B、向某溶液中滴加NaOH溶液,产生白色沉淀,白色沉淀可以是氢氧化铝、氢氧化镁、氢氧化锌等,该溶液中可能含有Al3+、Mg2+、Zn2+等,故B错误;
C、向某溶液中加入NaOH浓溶液,加热产生的气体能使湿润的红色石蕊试纸变蓝,该气体一定为氨气,原溶液中一定存在铵离子,故C正确;
D、紫红色溶液中加人过量Na2SO3溶液,溶液紫红色褪去,说明紫红色溶液具有氧化性,可以是含有碘单质或是高锰酸钾的溶液,不能确定溶液中一定含有MnO4-,古D错误;
故选C.
点评 本题考查化学实验方案的评价,涉及物质的检验、性质探究等知识,把握物质的性质的异同以及实验的严密性和合理性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HF、H2O、CH4、SiH4热稳定性由弱到强 | |
| B. | 微粒按半径从大到小顺序:K>Cl>K+ | |
| C. | C、N、O、F元素的最高正价由低到高 | |
| D. | 相同温度时物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH值由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )
室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )| A. | 随着盐酸加入,溶液中水的电离程度逐渐增大 | |
| B. | 随着盐酸加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | M 点,n(H+)-n(OH-)=(a×10-4-0.01)mol | |
| D. | 当 V(盐酸)=200mL时,c(CH3COO-)+c(CH3COOH)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| B. | 若按交叉分类法分类,碳酸钠既属于钠盐,又属于碳酸盐 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
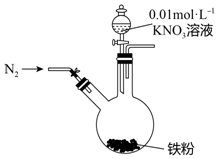 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:| 实验步骤 | 实验现象 |
| 1.打开弹簧夹,缓慢通入N2 | |
| 2.加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着. |
| 3.反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化. |
| 4将剩余固体过滤 | 表面的白色物质变为红褐色. |
| 实验步骤 | 实验现象 |
| 1.取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2.将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3.另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸. | 有气体生成,该气体使红色石蕊试纸变蓝. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com