
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,右向所得硝酸铜溶液中加入5mol·L-1 NaOH溶液至Cu2+恰好完全沉淀, 则消耗 NaOH溶液的体积是
A. 15mL B. 30 mL C. 45 mL D. 60 mL
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:_______________.
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为________________.
②X可能为____________(填代号).
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时转移的电子数目为________________.
②A的电子式为____________________。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为______(填代号).
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红.
则A与H2O反应的化学反应方程式为______.E是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质R是人类生命不可缺少的物质。已知R的摩尔质量为150g/mol,其中含碳元素40%,含氢元素6.7%,其余为氧元素。则R的化学式为
A.C5H10O2 B.C5H10O5 C.C6H6O D.C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③碘;④金刚石;⑤NaCl;⑥白磷,其中含有两种作用力的组合是( )
A.①②⑤
B.①③⑥
C.②④⑥
D.①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.6.02×1023就是阿伏加德罗常数
B.1mol氧含6.02×1023个O2
C.1mol任何气体所含的气体分子数目都相等
D.摩尔是国际单位制中的一个基本物理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等.某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
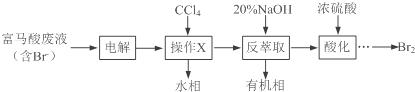
(1)操作X所需要的主要玻璃仪器为____________;反萃取时加入20%的NaOH溶液,其离子方程式为________________________.
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是_________.
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是____________________________.
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
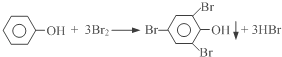
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:____________________________,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为____________mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量_________________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
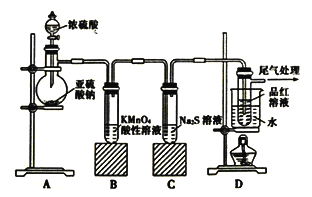
请回答下列问题:
(1)实验过程中,装置B中的现象是________________,原因是(用离子方程式表示)_____________。
(2)实验过程中,装置C中现象说明SO2具有的性质是_____________________。
(3)装置D中品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,可观察到的现象为__________。
(4)是否能将分液漏斗中的浓H2SO4换作浓HNO3,理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SiO2和CO2的叙述中不正确的是( )
A. 都是共价化合物
B. 都是酸性氧化物,都能与强碱溶液反应
C. 两者是同族元素的氧化物,熔点都很高
D. Si和C原子的杂化类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015北京理综化学】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11) ( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com