
| �¶� | 25�桫550�桫600�桫700�� |
| ��Ҫ�ɷ� | WO3 W2O5 WO2 W |
���� ���ٿ�ұ���٣������������������ơ�������Ӧ�����������������ƣ������̺��������Ʒ�Ӧ���������ƺ��������̣�ˮ��ʱ�����������������̲�����ˮ������������ˮ���ʹ��˺�õ�����Һ�������ƣ�����I����Ҫ�ɷ���Fe2O3��MnO2�������ƺ�Ũ���ᷴӦ��������������ƣ�����������⣬����+5�۵���Ϊ+6�ۣ������Ȼ�þ������������ˮ��MgSiO3��MgHAsO4��MgHPO4�����ˣ���ҺΪ�����ƣ��ữ�����ȷֽ�����������ٺ�ˮ���û�ԭ����ԭ�������������٣�
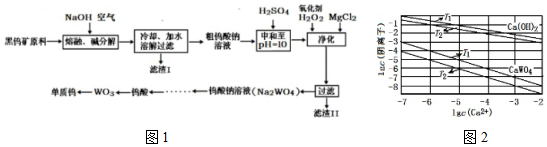
��1�������ڻ��������������ϼ۴�����Ϊ�㣬ȷ�������Σ�FeWO4��MnWO4������Ԫ�صĻ��ϼۣ���������ͼ����ʾ�̵������κ��������ƺ�������Ӧ����MnO2�����ʣ�
��2���������Ϸ���������H2O2��Ŀ���ǽ�HAsO32-������HAsO42-�����������Ҫ�ɷ���MgSiO3��MgHAsO4��MgHPO4��
��3����֪����WO2��s��+2H2��g��?W��s��+2H2O��g����H=+66.0KJ•mol-1
��WO2��s��?WO2��g����H=+203.9KJ•mol-1��
���ݸ�˹���ɣ���-�ڿɵ�WO2��g��+2H2��g��?W��s��+2H2O��g����
��4��T1ʱKSP��CaWO4��=c��Ca2+��•c��WO42-�������ݱ��и��¶������ӵ�Ũ�ȴ�����㼴�ɣ�����������Һ����ʯ����õ�����Ƴ��������������ӣ��ݴ���д���ӷ�Ӧʽ����Ӧƽ�ⳣ��K����������ƽ��Ũ��ϵ���η�֮���ͷ�Ӧ��ƽ��Ũ��ϵ���η�֮�����ݴ˼���T2ʱ�÷�Ӧ��ƽ�ⳣ����
��5�����ʱ�����õ����ӣ����ڵ������Һ�����Խ��ʣ����������������ӷŵ�����������̼������������̼���٣�WC��ʧȥ��������H2WO4��
��� �⣺��1��������FeWO4Ϊ���������������Σ�FeWO4��MnWO4���������̵Ļ��ϼ۶�Ϊ+2�ۣ���Ԫ�ػ��ϼ�Ϊ-2���������������ϼ۴�����Ϊ�㣬����Ԫ�صĻ��ϼ�Ϊ+6�����ٿ����Ҫ�ɷ��������̵������Σ���������ͼ����ʾ֪�����ٿ��ڿ�������������WO42-��MnO2����Fe2O3�ȣ�����ת��������MnO2�Ļ�ѧ��Ӧ����ʽΪ2MnWO4+O2+4NaOH$\frac{\underline{\;����\;}}{\;}$2MnO2+2Na2WO4+2H2O��
�ʴ�Ϊ��+6��2MnWO4+O2+4NaOH$\frac{\underline{\;����\;}}{\;}$2MnO2+2Na2WO4+2H2O��
��2���������Ϸ���������H2O2��Ŀ���ǽ�HAsO32-������HAsO42-�����ӷ���ʽΪH2O2+HAsO32-�THAsO42-+H2O����ҺI�д���SiO32-��HAsO32-��HAsO42-��HPO42-�����ӣ���������pHֵ�����Ȼ�þ��Mg2+����SiO32-��HAsO32-��HAsO42-��HPO42-�����ӣ����������Ҫ�ɷ���MgSiO3��MgHAsO4��MgHPO4��
�ʴ�Ϊ������HAsO32-����HAsO42-��MgSiO3��MgHAsO4��MgHPO4��
��3����֪����WO2��s��+2H2��g��?W��s��+2H2O��g����H=+66.0KJ•mol-1
��WO2��s��?WO2��g����H=+203.9KJ•mol-1��
���ݸ�˹���ɣ���-�ڿɵ�WO2��g��+2H2��g��?W��s��+2H2O��g��H=-137.9 kJ•mol-1��
�ʴ�Ϊ��WO2��g��+2H2��g��?W��s��+2H2O��g��H=-137.9 kJ•mol-1��
��4��T1ʱKSP��CaWO4��=c��Ca2+��•c��WO42-��=1��10-5��1��10-5=1��10-10������������Һ����ʯ���飬�������ֽⷴӦ���������ƺ���������ӷ�Ӧ��������Ƴ�������Ӧ�����ӷ���ʽΪ��WO42-+Ca��OH��2=CaWO4+2OH-��T2�¶���c��Ca2+��=10-4mol/Lʱ������ͼ���֪c��OH-��=10-2mol/L��c��WO42-��=10-7mol/L��ƽ�ⳣ��K����������ƽ��Ũ��ϵ���η�֮���ͷ�Ӧ��ƽ��Ũ��ϵ���η�֮������K=$\frac{{c}^{2}��O{H}^{-}��}{c��W{{O}_{4}}^{2-}��}$=$\frac{��1{0}^{-2}��^{2}}{1{0}^{-7}}$=1��103��
�ʴ�Ϊ��1��10-10��1��103��
��5�����ʱ�������������ӷŵ������������缫��Ӧʽ��2H++2e-=H2����������̼����ʧȥ���ӣ�����������Ӧ��WC+6H2O-10e-=H2WO4+CO2��+10H+��
�ʴ�Ϊ��WC+6H2O-10e-=H2WO4+CO2��+10H+��
���� �������ٿ�ԭ���Ʊ�W�Ĺ�������Ϊ���壬������������ԭ��Ӧԭ�����Թ������̵����⡢���û�ѧ����ȣ���Ŀ�Ѷ��еȣ�����������ǽ���Ĺؼ�����Ҫѧ��������ʵ�Ļ������ۺ�����֪ʶ��������������������


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
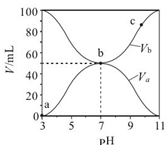
| A�� | Ka��HA��=10-6 mol•L-1 | |
| B�� | b ��ʱ��c��B+��=c��A-��=c��H+��=c��OH-�� | |
| C�� | c ��ʱ��$\frac{c��{A}^{-}��}{c��O{H}^{-}��•c��HA��}$���¶����߶���С | |
| D�� | a��c ������ˮ�ĵ���̶�ʼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �ڢܢݢ� | D�� | �ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
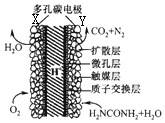 ֱ�����ص�صĽṹ��ͼ��ʾ������˵������ȷ���ǣ�������
ֱ�����ص�صĽṹ��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | ��ع���ʱ����ѧ��ת��Ϊ���� | |
| B�� | ��ع���ʱ��H+��Y����Ǩ�ƣ�Y����Χ��Һ��pH��С | |
| C�� | ̼��ز��ö�ײ��ô�ý��ɼӿ췴Ӧ���� | |
| D�� | Y���ĵ缫��ӦʽΪH2NCONH2+H2O-6e-�TN2��+CO2+6H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
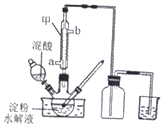 ���ᣨH2C2O4����һ����Ҫ���л�����ԭ�ϣ�Ϊ̽���������ȡ�����ʼ�Ӧ�ã���������ʵ�飮
���ᣨH2C2O4����һ����Ҫ���л�����ԭ�ϣ�Ϊ̽���������ȡ�����ʼ�Ӧ�ã���������ʵ�飮| ��� | H2C2O4��Һ | ���Ը��������Һ | �¶�/�� | ||
| Ũ��/mol•L-1 | ���/mL | Ũ��/mol•L-l | ���/mL | ||
| �� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| �� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| �� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
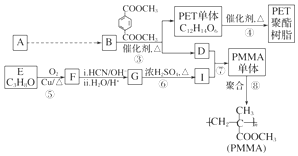
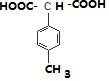 ��
�� ��
��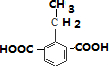 ��
�� ��
��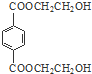 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com