
 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.分析 (1)①由元素守恒和原子守恒确定产物;
②由H2O2→O2知,双氧水在反应中作还原剂,所以还必须有氧化剂参加反应,在反应中得电子化合价降低,根据化合价知,高锰酸根离子作氧化剂,还原产物是锰离子,同时反应后生成水,据此写出离子方程式;
(2)①依据图象分析,开始无二氧化碳气体生成,是碳酸钠和盐酸反应生成碳酸氢钠的过程,当碳酸钠全部转化为碳酸氢钠后,再加入盐酸和碳酸氢钠反应生成二氧化碳气体,依据化学方程式计算得到样品中碳酸钠和碳酸氢钠物质的量对AB图象分析判断;
②根据计算出的碳酸钠和碳酸氢钠物质的量计算生成二氧化碳气体体积.
(3)依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值.
解答 解:(1)①由反应NaCN+H2O2+H2O═A+NH3↑,根据质量守恒定律可知,元素守恒、原子守恒,则A的化学式为NaHCO3,故答案为:NaHCO3;
②MnO4-具有氧化性,H2O2具有还原性,H2O2只发生了如下过程:H2O2→O2,则还原反应为MnO4-→Mn2+,并由质量守恒定律及电荷守恒可知,离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
(2)①图象分析可知B图象:碳酸钠生成碳酸氢钠消耗盐酸2.5ml,碳酸氢钠生成二氧化碳消耗盐酸7.5ml-2.5ml=5ml,Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2+H2O,则碳酸钠物质的量=0.0025L×1mol/L=0,0025mol,原混合物中的碳酸氢钠物质的量=0.005L×1mol/L-0.0025mol=0.0025mol,图象B合理,样品中碳酸钠和碳酸氢钠物质的量之比为1:1,天然碱的化学式为:Na2CO3•NaHCO3•2H2O;
图象A分析:碳酸钠生成碳酸氢钠消耗盐酸0.006ml,碳酸氢钠生成二氧化碳消耗盐酸7.5ml-6.0ml=1.5ml,Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2+H2O,则碳酸钠物质的量=0.006L×1mol/L=0.006mol,原混合物中的碳酸氢钠物质的量=0.0015L×1mol/L-0.006mol<0,所以图象A不符合反应过程的定量关系,故A不合理;
故答案为:B;Na2CO3•NaHCO3•2H2O;
②依据计算图象B可知碳酸钠物质的量=0.0025mol,碳酸氢钠物质的量=0.0025mol,根据碳元素守恒得到最大量生成二氧化碳物质的量=0.005mol,标准状况生成二氧化碳体积=0.005mol×22.4L/mol=0.112L=112mL,故答案为:112;
(3)2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,故答案为:3.
点评 本题考查了物质性质的实验探究方法和实验现象分析,反应的离子方程式书写,图象分析的计算判断,氧化还原反应电子转移数计算应用,侧重于学生的分析能力和计算能力的考查,掌握基础是关键,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 若b、c两点的平衡常数分别为K1、K2,则K1>K2 | |
| B. | a、b两点的反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法 | |
| D. | b、c两点的HBr的体积分数b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
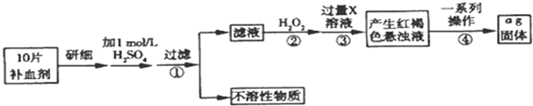
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 | |
| B. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| C. | 根据分散剂粒子的大小,将分散系分为溶液、浊液和胶体 | |
| D. | 根据纯净物的元素组成,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加人BaCl2溶液后,再加人稀硝酸观察沉淀的生成 | 检验是否含 SO42-离子 |
| B | 向某未知溶液中加人NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HCIO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g/mol | B. | 60 g/mol | C. | 90g/mol | D. | 120 g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com