
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
分析 溶液中除H+、OH-外,还含有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,由Al3+,Fe3+,Cl-所带的电荷3×1+3×1<1×7可知,溶液为酸性溶液,是氯化铝、氯化铁、氯化氢的混合溶液.
A、溶液呈酸性,滴加Na2CO3溶液先与酸反应;
B、根据电荷守恒计算氯化氢产生的氢离子浓度,在根据PH=-logc(H+)计算;
C、往溶液中加入NaOH溶液,溶解度小的先沉淀;
D、根据电荷守恒.
解答 解:溶液中除H+、OH-外,还含有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,由Al3+,Fe3+,Cl-所带的电荷3×1+3×1<1×7可知,溶液为酸性溶液,是氯化铝、氯化铁、氯化氢的混合溶液.
A、向溶液中滴加Na2CO3溶液,先与酸反应,不会立即产生沉淀和气体,故A错误;
B、若溶液中c(Cl-)=0.07 mol/L,则c(Al3+)=0.01mol/L,c(Fe3+)=0.01mol/L,则c(H+)×1+c(Al3+)×3+c(Fe3+)×3=c(Cl-)×1,即c(H+)×1+0.01mol/L×3+0.01mol/L×3=0.07mol/L×1,解得c(H+)=0.01mol/L,所以溶液PH=-logc(H+)=2,故B正确;
C、KSP[Fe(OH)3]<KSP[Al(OH)3]=6.0×10-18,组成相似,所以S[Fe(OH)3]<S[Al(OH)3],加氢氧化钠,溶解度小的先沉淀,故先出现红褐色沉淀,故C正确;
D、往溶液中通入NH3,铁离子、铝离子均被沉淀,由电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(Cl-),直至溶液呈中性,则c(H+)=c(OH-),得到C(NH4+)═C(Cl-),故D正确;
故选:A.
点评 本题考查溶液中离子共存问题、溶液计算等,综合性强,难度中等,判断溶液是氯化铝、氯化铁、氯化氢的混合溶液是解题关键.


科目:高中化学 来源: 题型:选择题
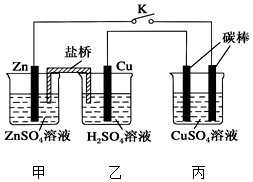 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
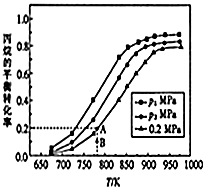 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com