


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ܵ���� | Mg��OH��2 | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
| �ܽ��/g | 9��10-4 | 1.7��10-6 | 1.5��10-4 | 3.0��10-9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ��ij��Һ���ȵμ���ˮ���ٵμ�����KSCN��Һ�� | ��Һ���Ѫ��ɫ | ��Һ�к���Fe2+ |
| B | ��10mL 0.2mol/L NaOH��Һ�е���2��0.1mol/L MgCl2��Һ��������ɫ�������ٵμ�2��0.1mol/LFeCl3��Һ | ��ɫ����ת��Ϊ���ɫ���� | ֤������ͬ�¶��µ�Ksp�� Mg��OH��2��Fe��OH��3 |
| C | �����£���Ũ������Ͷ����Ƭ | ��Ƭ���ܽ� | �����£�������Ũ���ᷴӦ |
| D | ��ʢ�е�ˮ���Թ��м���CCl4�������� | Һ��ֲ㣬�ϲ������ɫ���²��Ϻ�ɫ | ����CCl4�е��ܽ�Ƚϴ� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ֱ�ȡ�������Һ����εμ����ᣬ�����ݲ������ |
| B���ֱ�ȡ�����Թ��м��ȣ������ܲ���������ͨ�����ʯ��ˮ���۲����ް�ɫ���� |
| C���ֱ�ȡ�������Һ���μ�Ba��OH��2��Һ���۲����ް�ɫ���� |
| D���ֱ������Һ���ò�˿պȡ��Һ�ھƾ��ƻ��������գ��۲�������ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| A��-��2b+2c-a��kJ?mol-1 |
| B��-��a-2b-2c��kJ?mol-1 |
| C��-��b+c-a��kJ?mol-1 |
| D��-��a-b-c��kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
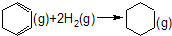 ����H=-237.1kJ/mol
����H=-237.1kJ/mol ����H=-208.4kJ/mol��
����H=-208.4kJ/mol��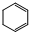 ȥ��ת������̬
ȥ��ת������̬ ���Ȼ�ѧ����ʽ��
���Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ |
| B��Na2CO3��Һ |
| C����ˮ |
| D��FeCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K=
| ||
| B����ʱ��B��ƽ��ת������60% | ||
| C���������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������ | ||
| D����������C��B��ƽ��ת���ʲ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com