
| A. | v(SO2)=4mol•L-1•min-1 | B. | v(O2)=3mol•L-1•min-1 | ||
| C. | v(SO2)=0.1mol•L-1•s-1 | D. | v(O2)=0.1mol•L-1•s-1 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
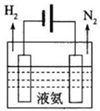 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.| 共价键 | H-H | N-H | N=N |
| 键能/kJ•mol-1 | 436 | 390.8 | 946 |
| NH3质量分数17%的氨水 | 无水 NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 40 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 450mL | B. | 500mL | C. | 400mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
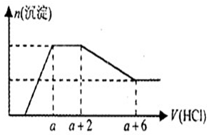 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应后形成的溶液溶质为NaCl | |
| C. | 原溶液中含有CO32-与AlO2-的物质的量比为1:1 | |
| D. | 原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com