
分析 (1)氯气与水反应生成HCl、HClO,HClO具有消毒作用;
(2)向AgNO3溶液中加入氯水,氯水中氯离子可以和银离子之间反应生成氯化银沉淀;
(3)氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性;
(4)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水.
解答 解:(1)氯气溶于水后生成了次氯酸和盐酸,氯气、水、次氯酸在离子反应中保留化学式,则离子反应为Cl2+H2O═H++Cl-+HClO,
故答案为:Cl2+H2O═H++Cl-+HClO;
(2)向AgNO3溶液中加入氯水,氯水中氯离子可以和银离子之间反应生成氯化银沉淀,即Cl-+Ag+=AgCl↓,氯水中起作用的主要微粒是Cl-,故答案为:Cl-;Cl-+Ag+=AgCl↓;
(3)氯气和水反应生成盐酸和次氯酸,盐酸具有酸性,氯水具有漂白性,向氯水中滴加石蕊试液,溶液变红,起作用的微粒是H+,后又褪色,起作用的微粒是HClO,
故答案为:H+;HClO
(4)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O.
点评 本题考查氯气的性质,为高频考点,把握发生的反应及电极反应为解答的关键,侧重分析与应用能力的考查,题目难度不大


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:解答题
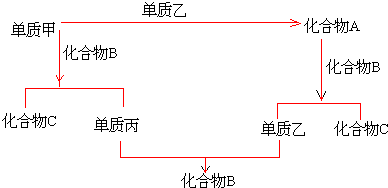
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L NH3中含氮原子数为 NA | |
| B. | 1 mol Na2O2与水完全反应时转移的电子数为NA | |
| C. | 100 mL 2.0 mol•L-1 NH4HCO3溶液中NH4+数为0.2NA | |
| D. | 1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
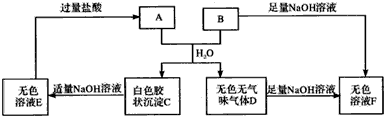
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
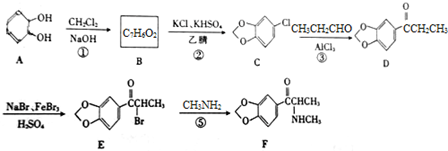
 ;
; (填结构简式);
(填结构简式); )的合成路线.
)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
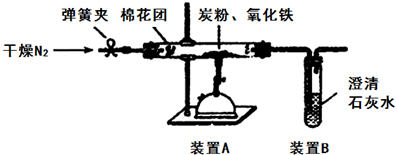
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.1 mol•L-1KCIO3溶液中含有的氯离子数目为NA | |
| B. | 标准状况下,22.4L H2O含有的分子数目为NA | |
| C. | 16g O2与16gO3含有的氧原子数目相等 | |
| D. | 1 mol Zn变为Zn2+时失去的电子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com