
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H=+85.
B(g)+C(g) △H=+85. 1kJ·mol-1
1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a |
| 0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1。
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
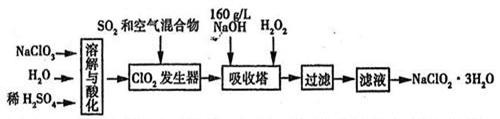
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性 B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450ml
l60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,
所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3) 吸收塔内的温度不能超过20℃,其主要目的是 _,吸收塔内发生反应的化学方程式为 。
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤 E、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加
了0.45 mol,则此反应的速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.v(NH3)=0.010 mol·L-1·s-1 B.v(O2)=0.001 0 mol·L-1·s-1
C.v(NO)=0.001 0 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度
为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K ,每次实
,每次实
验HNO3的用量为25.0 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和________探究温度对该反应速率的影响; (Ⅲ)实验①和________探究大理石规格 (粗、细)对该反应速率的影响。 |
| ② | ||||
| ③ | ||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:
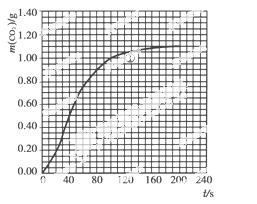
依据反应方程式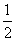 CaCO3+HNO3===
CaCO3+HNO3===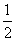 Ca(NO3)2+
Ca(NO3)2+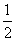 CO2↑+
CO2↑+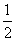 H2O,计算实验①在70~90 s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90 s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
A.在0~50 min之间,pH=2和pH=7时R的降解
百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间, pH=10时R的平均降解速率为
0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两物质的溶解度曲线如图所示.下列叙述中,正确的是  ( )
( )
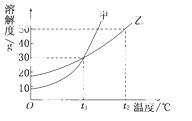 A.t1℃时
A.t1℃时 ,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,
甲先达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
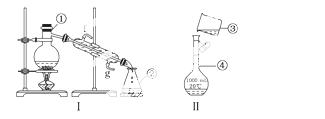
(1)写出下列仪器的名称:
① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的有 (填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;冷凝管的进水口是 (填“f”或“g”);现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A. 浓硝酸保存在玻璃塞的棕色试剂瓶中
B. 已经完成定容的500 mL 1.0 mol·L-1 的NaOH溶液,某同学不慎将容量瓶中溶液洒出,只能重新配制
C. 导管口点燃CO时需要验纯,H2加热还原CuO时也需要验纯
D. 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)  CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入
惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是 ( )
A.①② ④ B.①④⑥ C.②③⑤ D.③⑤⑥
④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com