
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
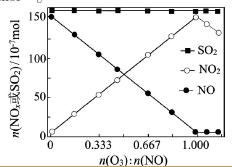 ②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
【答案】(1)-317.3;(2)①O3将NO2氧化成更高价氮氧化物;②SO2与O3的反应速率慢;(3)SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;(4)Ksp(CaSO3)×c(SO42-)/Ksp(CaSO4),CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率。
 【考点定位】考查反应热的计算、氧化还原反应方程式的书写、溶度积的计算等知识
【考点定位】考查反应热的计算、氧化还原反应方程式的书写、溶度积的计算等知识
【名师点睛】本试题涉及了热化学反应方程式的计算、根据图像推断可能出现的原因、氧化还原反应方程式的书写、溶度积的计算等知识,也就是主要体现化学反应原理考查,让元素及其化合物的性质做铺垫,完成化学反应原理的考查,让学生用基础知识解决实际问题,知识灵活运用。


科目:高中化学 来源: 题型:
下列关系正确的是( )
A.熔点:戊烷>2,2二甲基戊烷>2,3二甲基丁烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.含氢量:甲烷>乙烷>乙烯>乙炔>苯
D.同物质的量物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.溶度积大的化合物溶解度肯定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中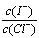 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
① 根据上述实验结果,该反应的平衡常数K的计算式为:___________。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重 新达到平衡,相应的点分别为_________________(填字母)
新达到平衡,相应的点分别为_________________(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)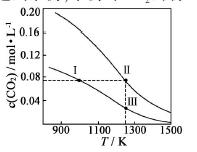 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
A.反应CO2(g)+c(s)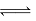 2CO(g) △S>0、△H<0
2CO(g) △S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | Na2O与Na2O2都能和水反应生成碱,它们是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(s,白磷)+5O2(g)===P4O10(s)
ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+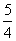 O2(g)===
O2(g)===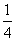 P4O10(s)
P4O10(s)
ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
相同状况下,能量状态较低的是______;白磷的稳定性比红磷____(填“高”或“低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com