
| A. | 放电时PbO2发生氧化反应 | |
| B. | 充电时电解质溶液的质量减少 | |
| C. | 放电时的负极反应式为Pb+SO42--2e-=PbSO4 | |
| D. | 充电时的阴极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
分析 A、放电时PbO2是正极,发生还原反应;
B、充电是电解池,生成硫酸,电解质溶液的质量增加;
C、放电时负极发生氧化反应,铅失电子生成硫酸铅;
D、充电时的阴极发生还原反应生成铅,阳极发生氧化反应生成二氧化铅.
解答 解:A、放电时PbO2是正极,发生还原反应,而不是氧化反应,故A错误;
B、充电是电解池,生成硫酸,电解质溶液的质量增加,而不是减小,故B错误;
C、放电时负极发生氧化反应,铅失电子生成硫酸铅,电极反应式为:Pb+SO42--2e-=PbSO4,故C正确;
D、充电时的阴极发生还原反应生成铅,阳极发生氧化反应生成二氧化铅,所以充电时的阳极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,故D错误;
故选C.
点评 本题考查了铅蓄电池的充电原理,侧重于学生的分析能力的考查,为高频考点,注意书写电极反应方程式来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 醋酸溶液中加入烧碱溶液:H++OH-═H2O | |
| C. | Ba(OH)2与 H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 |
 取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 | 放置一段时间后,生铁片上出现如图所示“斑痕”.其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈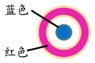 |
| A. | 生铁片发生吸氧腐蚀 | |
| B. | 中心区:Fe-2e-═Fe2+ | |
| C. | 边缘处:O2+2H2O+4e-═4OH- | |
| D. | 交界处:4Fe2++O2+10H2O═4 Fe(OH)3+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的质量不再改变 | |
| B. | 氯化氢的转化率不再改变 | |
| C. | 断开4 mol H-Cl键的同时生成4 mol H-O键 | |
| D. | n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量为17g•mol-1 | |
| B. | 0.5mol H2所占体积约为11.2L | |
| C. | 等质量的金刚石和晶体硅所含原子个数之比为7:3 | |
| D. | 1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | B. | Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 用AgNO3鉴别Na2CO3溶液和NaCl溶液 | |
| D. | 用足量的盐酸和BaCl2溶液鉴别溶液中是否含SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com