
| A. | 食盐和醋可作调味剂,也可用作食品防腐剂 | |
| B. | 植物秸秆不可用来制造酒精 | |
| C. | 镁合金可用于制造火箭、导弹和飞机的部件 | |
| D. | 二氧化硅可用于制光导纤维 |
分析 A.食盐具有咸味,食盐腌制食品,以抑制细菌的滋生,常用作调味品和防腐剂;醋酸既具有酸性,又具有酸味;
B.纤维素能水解生成葡萄糖,葡萄糖能转化为乙醇;
C.镁合金密度小、硬度大;
D.二氧化硅对光具有全反射作用,能传递光信号.
解答 解:A.食盐腌制食品,食盐进入食品内液产生浓度差,形成细菌不易生长的环境,可作防腐剂,食盐具有咸味,所以食盐可作调味剂;醋具有酸性,可作防腐剂,醋具有酸味,可作调味剂,故A正确;
B.纤维素能水解生成葡萄糖,葡萄糖在酒化酶的作用下能转化为乙醇,所以在一定条件下植物秸秆可用来制造酒精,故B错误;
C.镁合金密度小、硬度大,可用于制造火箭、导弹和飞机的部件,故C正确;
D.二氧化硅对光具有全反射作用,能传递光信号,所以二氧化硅可用于制光导纤维,故D正确.
故选B.
点评 本题考查常见的食品添加剂的组成、性质和作用、物质的结构性质和应用,题目难度不大,注意把握物质的性质和用途,侧重于考查学生对基础知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 1L 0.1 mol•L-1Na2CO3溶液中CO32-和HCO3-离子数之和为0.1 NA | |
| C. | 密闭容器中0.5mol H2与0.5mol I2充分反应,得到HI的分子数为NA | |
| D. | 30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、I-、SO42- | |
| B. | 使酚酞变红色的溶液:Na+、Al3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液:K+、Na+、NO3-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13 mol•L-1的溶液:Mg2+、Ca2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
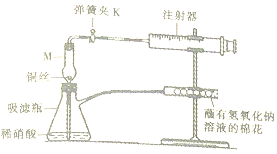 某化学兴趣小组对铜与硝酸的反应进行下列探究.
某化学兴趣小组对铜与硝酸的反应进行下列探究.| 操作步骤 | 实验现象 | 解释 |
| 打开弹簧夹K,拉注射器推筒,使稀硝酸吸到干燥管中并充满干燥管在关闭弹簧夹K | 仪器M中有无色气体 | 反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| 打开弹簧夹K,使干燥管中无色气体进入注射器中 | 注射器中有红棕色气体 | 反应的化学方程式为2NO+O2=NO2 |
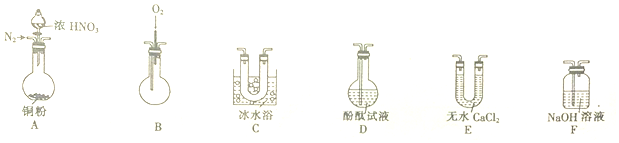
| 气体 | NO2 | NO |
| 液化温度 | 21℃ | -152℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的物质性质均与2-丁烯相同 | |
| B. | 氧化性:O3>O2 | |
| C. | 常温常压下,22.4L的2-丁烯中含C-H键数目为8×6.02×1023个 | |
| D. | 1molO3参与该反应,转移的电子数为6×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D216O、HTl6O共10g,所含分子数为0.25NA | |
| B. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| C. | 常温下1L0.1 mol/L A1C13溶液中阳离子数大于0.1NA | |
| D. | 1L0.1 mol/L Fe(NO3)3溶液参加反应,最多转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
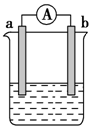 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
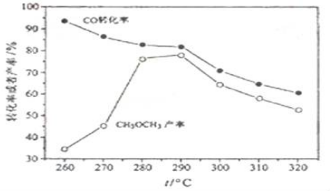 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com