
分析 (1)依据2H2(g)+O2(g)=2H2O(g) 放热483.6KJ,H2O(g)=H2O(l) 放热44kJ求出2H2(g)+O2(g)=2H2O(l)的反应热,逆反应与之热量相等,符合相反,根据反应热与化学计量数成正比求算H2O(l)=H2(g)+$\frac{1}{2}$O2(g)的反应热;
(2)根据反应热△H=反应物的总键能-生成物的总键能,据此计算△H,△H<0放热;
(3)根据离子方程式遵循电荷守恒判断RO3n-离子所带电荷,并以此判断化合价;根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第七主族元素;
(4)在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,溴元素化合价分别由+3价升高为+5价、由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既是氧化剂也是还原剂,部分水是还原剂,根据氧化还原反应中电子转移守恒计算被水氧化的BrF3的物质的量.
解答 解:(1)2H2(g)+O2(g)=2H2O(g)放热483.6KJ,H2O(g)=H2O(l) 放热44kJ,则2H2(g)+O2(g)=2H2O(l)放热483.6KJ+44KJ×2=571.6KJ,逆反应2H2O(l)=2H2(g)+O2(g)吸收571.6KJ热量,则H2O(l)=H2(g)+$\frac{1}{2}$O2(g)将会吸收285.8KJ的热量,
故答案为:吸收; 285.8;
(2)已知:H-H键能为436kJ•mol-1,H-N键能为391kJ•mol-1,N≡N键的键能945.6kJ•mol-1,对于反应N2(g)+3H2(g)=2NH3(g)的反应热△H=反应物的总键能-生成物的总键能=945kJ•mol-1+436kJ•mol-1×2-391kJ•mol-1×6=-93kJ•mol-1,△H<0放热,
故答案为:放出;93;
(3)根据离子方程式遵循电荷守恒可知:(-n)+(-6)+6=-1,可知n=1,根据RO3n-离子化合价代数和关系:(x-2×3)=-1(设R的化合价为x),可知x=+5,
RO3n-中R元素的化合价不一定为最高正价,应根据反应物中R-离子的化合价进行判断,根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第七主族元素,最外层电子数为7,
故答案为:+5;7;
(4)在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既是氧化剂也是还原剂,部分水是还原剂,该反应中有$\frac{2}{3}$的BrF3被还原,有$\frac{2}{5}$的H2O参加氧化还原反应,所以在该反应中被还原的BrF3与参加氧化还原反应的水之间计量数的关系是1:1,若有1mol水发生氧化反应,则被氧化的BrF3物质的量为1mol,
故答案为:1.
点评 本题考查了反应热、化学式判断化合价、氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意“RO3n-中R元素的化合价不一定为最高正价”,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| x的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| x的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ③ | ⑧ | ⑩ | ||||
| 4 | ① | ⑨ |
 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为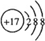 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

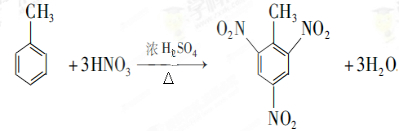
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com