
 O2(g)=CO(g);△H=-393.5kJ/mol
O2(g)=CO(g);△H=-393.5kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400kJ/mol科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| △H1-△H2 |
| 2 |
| △H1-△H2 |
| 2 |
| △H1 |
| △H3 |
| △H1 |
| △H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
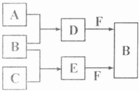 试回答:
试回答: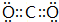
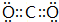
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | B、常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 | C、1mol硫酸与1mol Ba(OH)2完全中和所放出的热量为中和热 | D、在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com