
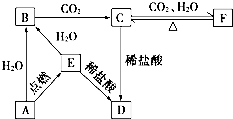
 如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.
如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、AlCl3为离子化合物 |
| B、P 与Cl可形成共价键 |
| C、SiCl4为共价化合物 |
| D、K与Mg 形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al 1s22s22p63s23p1 |
| B、S2- 1s22s22p63s23p4 |
| C、Na+ 1s22s22p6 |
| D、F 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na | B、Mg | C、Al | D、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com