
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:______、______、______。
(2)写出含B元素质量分数最高的化合物的电子式:___________________________
________________________________________________________________________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该
反应的离子方程式:________________________________________________________。
(4)用电子式表示化合物C2B的形成过程:_____________________________________。
科目:高中化学 来源: 题型:
在下列各组离子中能大量共存的是( )
A. K+、ClO-、SO42-、H+ B. K+、H+、NO3-、Fe2+
C. Na+、CO32-、Cl-、Ca2+ D. Na+、Cl-、SO42-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
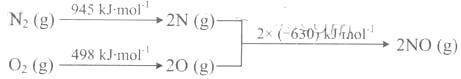
①写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
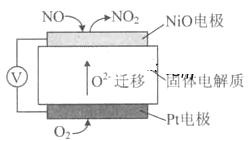
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。在化合物中,这四种元素常见化合价均不止一种,但有一种相同的化合价。其部分性质如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正价或最低负价 | +6 | -4 | +4 | -3 |
下列说法错误的是( )
A.四种元素在化合物中具有一种相同的化合价,即+4
B.高温下B可从C的氧化物中置换出C的单质
C.四种元素的最高价含氧酸均为强酸
D.只由非金属元素组成且含D元素的化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=== CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )。
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如下图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+ O2(g)
O2(g)  SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+ O2(g)
O2(g)  SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 NaHCO3溶液:K+、AlO 、Cl-、NO
、Cl-、NO
B.使甲基橙变红色的溶液:NH 、Cu2+、ClO-、Na+
、Cu2+、ClO-、Na+
C.c(H+)=1×10-13 mol∙L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D.遇苯酚变紫色的溶液:Na+、Mg2+、SO 、Cl-
、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com