
某乙醇水溶液的质量分数为w%,物质的量浓度为cmol/L,密度为dg/mL,1Kg这种溶液中含有的乙醇是:
A.46C B.c/d mol C.c mol D.1000dw g
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装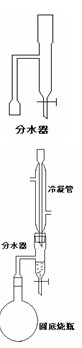 置及胶塞等略。
置及胶塞等略。
![]() 实验步骤如下:
实验步骤如下:
![]() I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
![]() II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
![]() III. 当不再有水生成,停止加热。
III. 当不再有水生成,停止加热。
![]() IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
![]() V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
![]() 根据以上操作过程回答以下问题:
根据以上操作过程回答以下问题:
![]() (1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
(1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
![]() (2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
(2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
![]() (3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
(3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
①洗去反应剩余的苯甲酸 ②洗去反应混合液中的乙醇
③降低苯甲酸乙酯的溶解度,有利于析出、分层,便于下一步的分液
④有利于苯甲酸乙酯的水解
(4)写出该反应的化学方程式
(5)实验过程中,如果温度过高会发生副反应,产生一种能使溴的四氯化碳溶液褪色的
无色稍有气味的气体,该气体的结构简式为
(6)实验结束收集分水器分离出的水,并测得质量为1.44g,计算苯甲酸乙酯的产率为 。实验中苯甲酸乙酯的实际产率总是小于此计算值,其原因可能是
①加热过程中乙醇挥发,冷凝后滴入分水器中,随冷凝的水一起被分出
②实验过程中,发生了副反应
③苯甲酸乙酯洗涤、蒸发过程中有损失。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com