
如下图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )
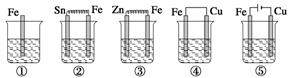
A.⑤②①③④ B.④③①②⑤ C.⑤④②①③ D.③②④①⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于乙醇的说法不正确的是( )
A.可用纤维素的水解产物制取
B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体
D.通过取代反应可制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
敌草胺是一种除草剂。它的合成路线如下:



已知:RCH2COOH
 ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备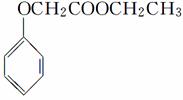 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C===CH2 CH3CH2Br
CH3CH2Br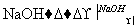 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式:________________________________________________________________________
________________________________________________________________________。
(2)此电池的正极发生的电极反应:________________________________________________________________________,
负极发生的电极反应: __________________________________________________。
(3)电解液中H+向________极移动,向外电路释放电子的电极是________。
(4)使用该燃料电池的另一个好处是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香族化合物A,分子式为C9H9OCl,且能发生银镜反应;D为含有八元环的芳香族化合物。A与其它物质之间的转化如下图所示:

(1)A的结构简式为 。
(2)A→E的反应条件为 ;C→D的反应类型为 。
(3)写出B→C第①步的反应方程式 。
(4)B的一种同系物F(分子式为C8H8O2)有多种同分异构体,则含有 的芳香族化合物的同分异构体有 种,写出其中核磁共振氢谱有4个峰的一种结构简式 。
的芳香族化合物的同分异构体有 种,写出其中核磁共振氢谱有4个峰的一种结构简式 。
(5)已知: 由甲苯及其它必要物质经如下步骤也可合成B:
由甲苯及其它必要物质经如下步骤也可合成B:

反应I的试剂及条件为 :反应IV所用物质的名称为 ;
反应III的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了避免青铜器生成铜绿,以下方法正确的是( )
①将青铜器放在银质托盘上 ②将青铜器保存在干燥的环境中 ③将青铜器保存在潮湿的空气中 ④在青铜器的表面覆盖一层防渗的高分子膜
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的
4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中, 正确的是( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
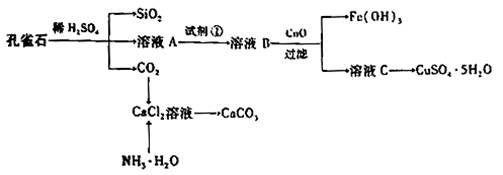
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b. (NH4) 2S c. H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过 等操作。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置回收(填代号)。
Ⅱ.(1)某同学欲从含FeCl3、FeCl2、CuCl2的废液中回收金属铜,取上述1L废液加入铁粉,充分反应。所加铁粉的物质的量与废液中铜离子的物质的量的关系曲线如图:
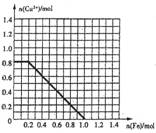 已知原废液中c(Cl-)=6.0mol.L-1,则原废液中c(Fe3+)= ,c(Fe2+)= 。(忽略水解及溶液体积变化)
已知原废液中c(Cl-)=6.0mol.L-1,则原废液中c(Fe3+)= ,c(Fe2+)= 。(忽略水解及溶液体积变化)
(2)现有Fe2O3、ZnO、CuO的混合固体粉末ag,在加热条件下用足量的CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。请回答下列问题:
①a= 。
②若agFe2O3、ZnO、CuO的混合物总物质的量为bmol,则Fe2O3的物质的量为 。(用含b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com