
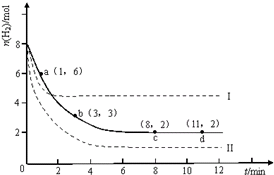
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(
电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(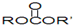 )作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
)作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )| A、放电时Li+移动方向与曲线①一致 |
| B、电解质溶液不能用醋酸溶液代替碳酸酯类 |
| C、充电时阴极反应式:Li++e-═Li |
| D、充电时b电极接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
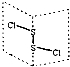 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体.下列说法错误的是( )| A、S2Cl2的结构中各原子均达到8电子的稳定结构 |
| B、S2Cl2为含有极性键和非极性键的共价化合物 |
| C、若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2 |
| D、S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
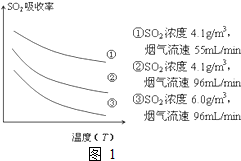 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
| 滴定次数 | 待测溶液 的体积/mL |
标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
| B、NaHS溶液呈碱性:H3O++HS-?H2S+H2O |
| C、4mol/L的KAl(SO4)2溶液与7mol/L的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-═2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O |
| D、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
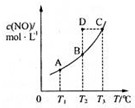 在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )| A、该反应的△H>0 |
| B、若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| C、在T2时,若反应体系处于状态D,则这时一定有v正<v负 |
| D、在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com