
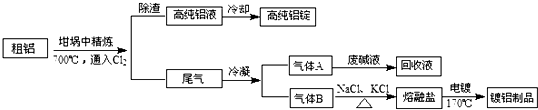
分析 粗铝700°C通入氯气在坩埚中精炼,将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3,除渣得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为Cl2,废碱液回收得到回收液;B固体加入氯化钠氯化钾加热得到熔融盐电镀得到镀铝制品,
(1)根据氧化铁和石英砂(主要成分是二氧化硅)能分别与铝发生置换反应来书写方程式;
(2)根据题中信息:NaCl熔点为801℃;AlCl3在181℃升华,在结合物质之间的反应来分析;
(3)酸性气体能和强碱反应,用烧碱来处理尾气;
(4)铝金属表面形成的致密氧化铝膜具有保护作用;
(5)铝与过量NaOH溶液反应生成偏铝酸钠和氢气,偏铝酸钠溶液中通入过量CO2,会生成氢氧化铝沉淀,据此答题;
解答 解:粗铝700°C通入氯气在坩埚中精炼,将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3,除渣得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为Cl2,废碱液回收得到回收液;B固体加入氯化钠氯化钾加热得到熔融盐电镀得到镀铝制品,
(1)氧化铁和二氧化硅分别与铝发生的是置换反应(单质和化合物发生反应生成新单质和化合物的反应),即2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,4Al+3SiO2$\frac{\underline{\;高温\;}}{\;}$3Si+2Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;4Al+3SiO2$\frac{\underline{\;高温\;}}{\;}$3Si+2Al2O3;
(2)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为801℃,较高,是固态杂质随气泡上浮,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3,
故答案为:H2、HCl、AlCl3;NaCl;
(3)A中有氯气以及氯化氢,均能和烧碱反应,用于尾气处理,实质为:Cl2+2OH-=Cl-+ClO-+H2O,H++OH-=H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(4)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生,
故答案为:致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生;
(5)铝与过量NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,偏铝酸钠溶液中通入过量CO2,会生成氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查了物质分离提纯的流程分析判断,物质性质和试剂作用于产物的判断是解题关键,是一道有关金属的工业制备知识题目,考查角度广,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含有FeCl3 | |
| B. | H3PO3+2NaOH(足量)=Na2HPO3+2H2O,H3PO3属于三元酸 | |
| C. | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀酸雨中一定含有SO42- | |
| D. | CaO$\stackrel{H_2{O}}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH 用生石灰制备NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肉类富含蛋白质,属于碱性食物 | |
| B. | 碳酸氢钠可用于治疗胃酸过多 | |
| C. | 碘是人体必需的微量元素之一 | |
| D. | 食用富含维生素C的水果有益于身体健康 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com