
分析 (1)根据双原子单质分子有3种,确定该元素存在两种同位素;
(2)根据两种同位素形成的3种单质的式量分析两种同位素的质量数为79、81;
(3)根据3种分子物质的量之比求各同位素的原子数之比,结合平均式量的计算依据是总质量与总物质的量之比计算.
解答 解:(1)元素构成的双原子单质分子有3种,其式量分别为158、160、162,推断该元素存在两种同位素才符合,若是三种同位素则形成的单质应为6种;
答:X元素有2种同位素;
(2)该元素的两种同位素的原子设为M、N,构成的双原子单质分子有3种,其式量分别为158、160、162,则该元素的同位素质量数只有79、81,形成的单质为79M2、79M81N、81N2三种单质;
故:X元素的同位素的质量数分别是79、81;
(3)该元素形成的单质为79M2、79M81N、81N2三种单质,三种单质的物质的量之比为1:1:1,则各同位素的原子数之比为3:3=1:1,近似相对原子质量=$\frac{1×79+1×81}{2}$=80;
答:X元素的近似相对原子质量是80.
点评 本题考查了元素同位素的综合应用,以同位素为载体考查了质量数的确定和计算,近似相对原子质量的计算方法,题目较难.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,烷烃 的名称是2,4-二甲基-2-乙基戊烷 的名称是2,4-二甲基-2-乙基戊烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下都能发生水解反应 | |
| D. | 丙烯酸(CH2═CH-COOH)能发生取代、氧化、还原、加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
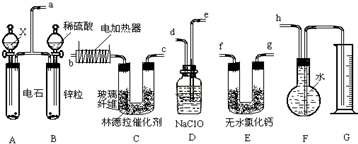
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从I2的CCl4溶液中得到CCl4,可用蒸馏法 | |
| B. | 从Na2CO3溶液中得到Na2CO3,可用过滤法 | |
| C. | 分离酒精和CCl4的混合物,可用分液法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
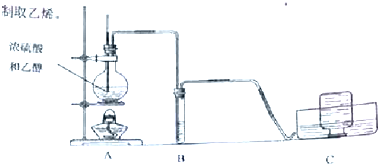
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com