
下列物质的沸点逐渐升高的是( )
|
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 |
|
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
考点:
晶体熔沸点的比较.
分析:
A.氨气分子之间存在氢键,沸点高于PH3;
B.原子晶体沸点高于分子晶体,金刚石、晶体硅属于原子晶体,原子半径越小,键能越大,熔沸点越高,水与二氧化碳均形成分子晶体,常温下水为液态,而二氧化碳为气体;
C.晶格能越大,离子晶体熔沸点越高,离子电荷越大、半径越小,晶格能越大;
D.金属键越强,金属晶体的熔沸点越高,离子电荷越大、半径越小,金属键越强.
解答:
解:A.氨气分子之间存在氢键,沸点高于PH3,故A错误
B.金刚石、晶体硅属于原子晶体,原子半径C<Si,故键能C﹣C键>C﹣Si键,故沸点Si<SiC,水与二氧化碳均形成分子晶体,常温下水为液态,而二氧化碳为气体,水的沸点较高,原子晶体的沸点高于分子晶体,故B错误;
C.均为离子晶体,离子所带电荷相同,离子半径I﹣>Br﹣>Cl﹣>F﹣,故NaI、NaBr、NaCl、NaF的晶格能依次增大,离子晶体沸点升高,故C正确;
D.离子所带电荷相同,离子半径径Li+<Na+<K+<Rb+,金属键减弱,金属晶体的沸点降低,故D错误,
故选:C.
点评:
本题考查晶体熔沸点高低比较,难度不大,注意理解掌握熔沸点高低比较规律,有利于基础知识的巩固.


科目:高中化学 来源: 题型:
关于次氯酸性质的描述,错误的是( )
|
| A. | 不稳定,易分解放出氧气 | B. | 能使潮湿的有色布条褪色 |
|
| C. | 具有漂白作用和消毒作用 | D. | 是一种比碳酸酸性强的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) |
|
| C. | 电池工作时,电子由正极通过外电路流向负极 |
|
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
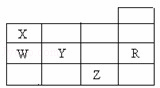
|
| A. | 常压下五种元素的单质中,Z单质的沸点最高 |
|
| B. | Y、Z的阴离子电子层结构都与R原子的相同 |
|
| C. | W的氢化物的沸点比X的氢化物的沸点高 |
|
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
|
| A. | 配位体是Cl﹣和H2O,配位数是9 |
|
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
|
| C. | 内界和外界中的Cl﹣的数目比是1:2 |
|
| D. | 加入足量AgNO3溶液,所有Cl﹣均被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形 ,该分子是 (填“极性”或“非极性”)分子.
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: .
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) .
(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
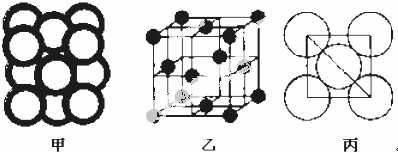
c单质晶体中原子的配位数为 .若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为 (用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
|
| A. | Na2CO3是碱 | B. | Na2CO3是盐 | C. | Na2CO3是正盐 | D. | Na2CO3是钠盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com