
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
| 1 |
| 2 |
| 0.429g |
| 2g |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:物理教研室 题型:022
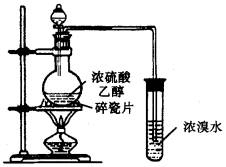
(1)烧瓶中液体呈棕黑色的原因____________________________.
(2)一些同学认为:溴水褪色的现象不能证明反应中有乙烯生成,且乙烯具有不饱和性,因为棕黑色物质会与浓H2SO4反应生成某气体,该气体使溴水褪色的反应方程式为_______
_______.
另一些同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成且乙烯具有不饱和性.这个现象是_________________________.
(3)为了控制烧瓶中液体的温度,该小组改用图装置实验时,先将烧瓶置于润滑油(沸点、燃点均高于300℃)中然后加热,并控制在170℃左右.结果试管中溴水未完全褪色,液面上形成一层深红棕色液体.产生这个现象的原因是烧瓶中发生反应生成液体X,其反应方程式为______________________________________.
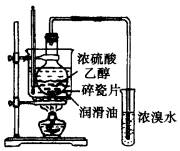
若利用上图制较多的乙烯,正确的加热操作顺序是先_____________________________
_____________________后_________________________________.
(4)处理上述实验后烧瓶中废液的正确操作是________.
A.废液倒入下水道
B.废液倒入空废液缸中
C.将水倒入烧瓶中
D.废液倒入盛水的塑料桶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com