
下列离子的检验方法中正确的是( )
|
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl﹣ |
|
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42﹣ |
|
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
|
| D. | 某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
考点:
常见阳离子的检验;常见阴离子的检验.
专题:
物质检验鉴别题.
分析:
A、未滴加稀硝酸酸化,不能排除CO32﹣等离子的干扰;
B、应先滴加稀盐酸酸化,再滴加BaCl2溶液;
C、Cu2+能与NaOH溶液反应生成氢氧化铜蓝色沉淀;
D、加碱生成的红褐色沉淀为氢氧化铁,氢氧化镁沉淀为白色.
解答:
解:A、未滴加稀硝酸酸化,不能排除CO32﹣等离子的干扰,故A错误;
B、未先滴加稀盐酸酸化,不能排除Ag+、CO32﹣等离子的干扰,故B错误;
C、Cu2+能与NaOH溶液反应生成氢氧化铜蓝色沉淀,故C正确;
D、加碱生成的红褐色沉淀为氢氧化铁,证明含铁离子,氢氧化镁沉淀为白色,故D错误;
故选C.
点评:
本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握离子的检验方法、试剂及现象与结论为解答的关键,侧重离子检验的考查,注意检验应排除干扰离子,题目难度不大.


科目:高中化学 来源: 题型:
利用“化学蒸气转移法”制备TaS2晶体,某温度下的2L恒容密闭容器中加入一定量 的 I2(g)和TaS2(s)发生如下反应:TaS2(s)+2I2(g)⇌TaI4(g)+S2(g)△H=a kJ•mol﹣1 (Ⅰ)达平衡时,TaS2(s)、I2(g)、TaI4(g)、S2(g)的物质的量分别为3mol、2mol、2mol、2mol.
(1)反应(Ⅰ)的平衡常数表达式K=
(2)若该温度下该容器中某时刻TaS2(s)、I2(g)、TaI4(g)、S2(g)的物质的量分别为2mol、2mol、4mol、4mol,则该时刻平衡向 (填“正反应”或“逆反应”)移动,v正 v逆(填“>”、“=”或“<”).
(3)在不同温度下,该反应的平衡常数K如下表:
| 温度/℃ | 40 | 80 | 200 |
| 平衡常数K | 1 | 1.5 | 4 |
该反应的△H 0(填“>”、“=”或“<”).
(4)40℃时,向该恒容密闭容器中加入2mol I2(g)和4mol TaS2(s),I2(g)的平衡转化率为 写出计算过程,结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子的检验方法中正确的是( )
|
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl﹣ |
|
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42﹣ |
|
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
|
| D. | 某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
|
| A. | ①和② | B. | ①和③ | C. | ③和④ | D. | ①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 摩尔是6.02×1023个结构微粒的集体 |
|
| B. | 0.012kg12C所含的原子数精确值是6.02×1023 |
|
| C. | 1molH就是1mol氢 |
|
| D. | 1molH2SO4的质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1molCH3+(碳正离子)含有9 NA个电子 |
|
| B. | 2.5molHe 中含有10 NA个质子 |
|
| C. | 6.02×1022 个H2SO4分子在溶液中可电离出2NA个H+ |
|
| D. | 1molFe与盐酸完全反应可失去电子的物质的量为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用NaOH固体配制480mL 1.0mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH固体的质量 g
(2)实验仪器除了托盘天平、药匙、烧杯、玻璃棒外,还应有
(3)容量瓶上需标有以下五项中的 (序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)使用容量瓶前必须进行的一步操作是 .
(5)配制时,其正确的操作顺序是
A、用30mL水洗涤烧杯2﹣3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
(6)下列配制的溶液浓度偏大的是
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,下列研究目的和示意图相符的是()
A B C D
研究目的 压强对反应的影响
(p2>p1) 温度对反应的影响 平衡体系增加O2的浓度对反应的影响 体积恒定的密闭容器中催化剂对反应的影响
图示 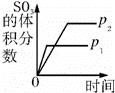
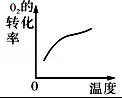
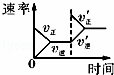

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B. 热化学方程式中,各物质前的化学计量数不表示分子个数
C. 在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com