
| A. | SiO2、NaCl、CO2 | B. | HF、HCl、HBr | C. | NaCl、KCl、RbCl | D. | Na、Mg、Al |
分析 A.一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体;
B.氢化物的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高;
C.离子晶体熔沸点与离子半径成反比,与电荷成正比;
D.金属晶体与金属键有关,金属键与原子半径成反比、与电荷成正比.
解答 解:A.一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体,SiO2、NaCl、CO2分别是原子晶体、离子晶体、分子晶体,所以熔沸点由低到高顺序是CO2、NaCl、SiO2,故A错误;
B.氢化物的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高,HF中含有氢键,熔沸点最高,所以这几种物质熔沸点由低到高顺序是HCl、HBr、HF,故B错误;
C.离子晶体熔沸点与离子半径成反比,与电荷成正比,阳离子半径大小顺序是Rb+>K+>Na+,所以熔沸点由低到高顺序是RbCl<KCl<NaCl,故C错误;
D.金属晶体与金属键有关,金属键与原子半径成反比、与电荷成正比,原子半径大小顺序是Na、Mg、Al,金属阳离子所带电荷大小顺序是Al>Mg>Na,所以单质熔沸点由低到高顺序是Na<Mg<Al,故D正确.
故选D.
点评 本题考查晶体熔沸点高低判断,明确影响晶体熔沸点因素是解本题关键,知道常见晶体类型,易错选项是B,注意化学键只影响共价化合物的稳定性,分子间作用力及氢键影响共价化合物的熔沸点,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | 对羟基苯甲醛的沸点比邻羟基苯甲醛高 | |
| C. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| D. | NH4+中4个N-H键的键能不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
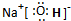 物质I是极性分子(填极性或非极性)
物质I是极性分子(填极性或非极性)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
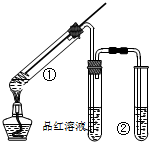 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛分子组成中仅有C、H两种元素 | |
| B. | 甲醛是一种无色无味的气体,对人体无危害,所以,可以放心饮用啤酒 | |
| C. | 甲醛的化学性质很稳定,很难与强酸、强碱、强氧化剂反应 | |
| D. | 甲醛既可以被氧化生成甲酸、也可以还原生成甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com