
 在
在| T | 1 |
| T | 1 |
| T | 1 |
| T | 2 |
| T | 1 |
| ||
| △t |
| T | 1 |
| 2x |
| 1-x+3-3x+2x |
| ||
| 10min |
| 0.4mol |
| 1mol |
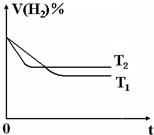 ,故答案为:
,故答案为: ;
;| T | 1 |


科目:高中化学 来源: 题型:
 元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体.
元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量SO2通入Ba(NO3)2溶液3SO2+2NO3-+3Ba2++2H2O═3BaSO4+2NO+4H+ | ||
| B、1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||
C、甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-
| ||
| D、向硫酸铝铵矾溶液中滴加过量的氢氧化钡溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42- |
| B、加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO3- |
| C、NaHCO3溶液中:C6H5O-、CO32-、Br-、K+ |
| D、c(Ca2+)=0.1mol?L-1的溶液中:NH4+、SiO32-、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS |
| B、探究SO2和Na2O2反应可能有Na2SO4生成 |
| C、探究Na与水的反应可能有O2生成 |
| D、向滴有酚酞的NaOH溶液中通入 Cl2,探究红色褪去的原因是溶液的酸碱性变化还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 | SO42-、OH-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L乙烷分子含极性键数6NA |
| B、0.1 molNa与足量水反应生成H2 0.1NA |
| C、46gNO2气体中氧原子总数为2NA |
| D、15 g甲基(-CH3)所含的电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等物质的量浓度等体积的醋酸溶液和醋酸钠溶液混合后,混合液中:C(CH3COO-)+2C(OH-)=2C(H+)+C(CH3COOH) |
| B、将pH=a的醋酸溶液稀释l倍后,pH:b,则a一定大于b |
| C、在滴有酚酞试液的氨水中加入NH2C1固体至溶液恰好无色时,则溶液pH:7 |
| D、菜醋酸与醋酸钠的混合液pH=5.6,其中C(CH3COO-)<C(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com