
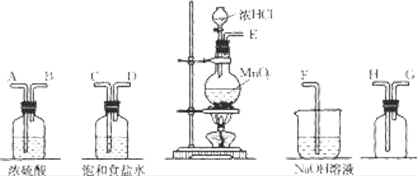
分析 (1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,据此解答;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,依据氯气、氯化氢的溶解性选择合适的除杂剂,依据浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是 E C D A B H G F,
故答案为:C; D; A;B;H; G;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,所以当0.5mol MnO2参与反应时,被氧化的HCl的质量为1mol,质量为36.5g;生成氯气的物质的量为0.5mol,标况下气体的体积为0.5mol×22.4L/mol=11.2L;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 36.5g; 11.2L;
(3)盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯气中的氯化氢;
浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
故答案为:除去Cl2中的HCl; 干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,化学方程式为Cl2+2 KI=I2+2 KCl,碘遇到淀粉变蓝;
故答案为:试纸变蓝;Cl2+2 KI=I2+2 KCl;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2 NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2 NaOH=NaCl+NaClO+H2O.
点评 本题考查了实验室制备干燥纯净的氯气的实验步骤和试剂选择,明确制备原理和氯气的性质是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和4He是同一种原子 | B. | 比4He少一个质子 | ||
| C. | 是4He的同位素 | D. | 比4He多一个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
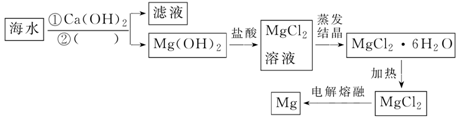
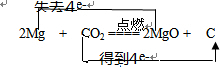 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
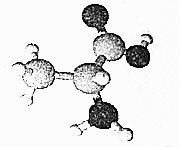
| A. | 常温常压下呈气态 | |
| B. | 分子式为C3H8O2N | |
| C. | 与H2NCH2COOH互为同系物 | |
| D. | 分子中所有C、N原子均处于同一平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com