
| A、CaSO4 |
| B、CaSO3 |
| C、CaS |
| D、SO3 |
| ||
| ||
| ||
| ||


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
 ,下列说法中错误的是( )
,下列说法中错误的是( )| A、X可以是金属 |
| B、X可以是非金属 |
| C、m可以等于1或2 |
| D、XYm与XYn的相互转化是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图里有6个编号,每个编号代表下列物质中的一种物质,凡用直线连接的相邻两种物质均能发生化学反应,供填写的物质有:a.碳酸钠溶液;b.硫酸镁溶液;C.氯化钡溶液;d.稀硫酸;e.铁;f.硝酸铜溶液,则图中③表示的物质的编号是( )
如图里有6个编号,每个编号代表下列物质中的一种物质,凡用直线连接的相邻两种物质均能发生化学反应,供填写的物质有:a.碳酸钠溶液;b.硫酸镁溶液;C.氯化钡溶液;d.稀硫酸;e.铁;f.硝酸铜溶液,则图中③表示的物质的编号是( )| A、e | B、f | C、a | D、d |
查看答案和解析>>
科目:高中化学 来源: 题型:
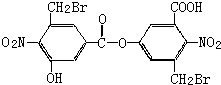
| A、该有机物的分子式为:C16H9O8N2Br2 |
| B、向该有机物溶液中加入FeCl3溶液,振荡后有紫色沉淀产生 |
| C、1mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗6 mol NaOH |
| D、该有机物在稀硫酸中加热水解,有机产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应I2(aq)+I-(aq)?I3-(aq)的△H<0 |
| B、若温度为T1、T2,反应物的转化率分别为a1、a2,则a1>a2 |
| C、若反应进行到状态D时,一定有v正<v逆 |
| D、状态A与状态B相比,状态B的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的KAl (SO4)2溶液中:c (SO42-)>c (Al3+)>c (OH-)>c (H+) |
| B、10 mL 0.01mol?L-1HCl溶液与10 mL 0.01mol?L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| C、在0.1mol?L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液呈酸性,有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
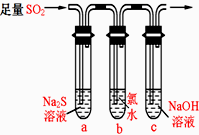 某学习小组设计用如下装置验证二氧化硫的化学性质.
某学习小组设计用如下装置验证二氧化硫的化学性质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com