
下列说法正确的是
A.NH3的摩尔质量为17g
B.1mol/LMgCl2溶液中含有1mol镁离子和2mol氯离子
C.1molN2的体积为22.4L
D.常压下200℃时,18克的水与2克H2体积比约为1:1
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2016-2017学年河北石家庄一中高二上期中考试化学试卷(解析版) 题型:选择题
下列物质进行一氯取代反应后,只能生成4种沸点不同的有机产物的是
A.
B.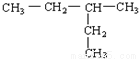
C.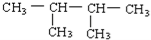
D.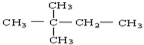
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃静宁一中高一上月考二化学试卷(解析版) 题型:选择题
下列离子方程式中,只能表示一个化学反应的是
①CO32-+2H+=CO2↑+H2O
②Ba2++2OH-+2H++SO=BaSO4↓+2H2O
③Ag++Cl-=AgCl↓
④Fe+Cu2+=Fe2++Cu
⑤Cl2+H2O=H++Cl-+HClO
A.①③
B.②④
C.②⑤
D.只有⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽铜陵市高一上期中考试化学试卷(解析版) 题型:实验题
下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
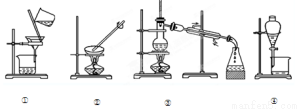
从海水中提取水:从KCl溶液中获取KCl晶体
分离CaCO3和水;分离植物油和水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽铜陵市高一上期中考试化学试卷(解析版) 题型:选择题
下列化学方程式中,不能用离子方程式,Ba2++SO42-=BaSO4↓表示的是
A.Ba(NO3)2+Na2SO4=BaSO4↓+2HNO3
B.BaCl2+H2SO4=BaSO4↓+2NaCl
C.Ba(OH)2+K2SO4=BaSO4↓+2KOH
D.Ba(OH)2+H2SO4=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、六合等七校高三上期中化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、六合等七校高三上期中化学试卷(解析版) 题型:选择题
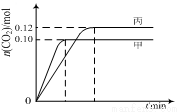
一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是( )
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是( )
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市六校高三上10月联考化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术]
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
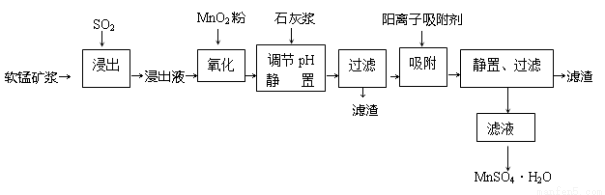
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
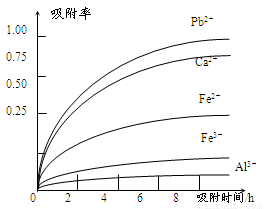
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式_________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源:贵州省铜仁市2016-2017学年高一上期中化学试卷(解析版) 题型:实验题
用Na2CO3·10H2O晶体,配制0.2mol/L的Na2CO3溶液480mL。
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、胶头滴管,还缺少。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为g。
(3)配制溶液时有以下几个操作:①溶解、②摇匀、③洗涤并转移、④冷却、⑤称量、⑥转移溶液、⑦定容、⑧装瓶贴标签,则正确的操作顺序是 (填序号)。
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空。
①碳酸钠失去了部分结晶水
②用“左码右物”的称量方法称量晶体并使用了游码
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
⑥转移液体时不小心洒落了一滴在容量瓶的外面
⑦定容时俯视刻度线,
⑧摇匀后,凹液面低于刻度线未做任何处理
其中引起所配溶液浓度偏高的有,偏低的有,无影响的有。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com