
【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物) 为原料制备Mg CO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为:
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O H = -50.4kJ·mol-1
Mg2SiO4(s) +4 H+(aq)=2 Mg2+(aq) +H2SiO3(s) + H2O(l) H =-225.4kJ··mol-1
向Mg2SiO4悬浊液中通入CO2析出H2SiO3的热化学方程式为__________,该反应能正向进行的热力学原因是_________。该反应的平衡常数表达式为__________。
(2)对氧化后的溶液,加入萃取剂磷酸二异辛酯(C16H35O4P)的煤油溶液,并调节pH为1.4~4.3,萃取剂的体积约为水溶液的0.5倍,充分振荡、静止、分层(上层为含三价铁的有机层),分液。向分液得到的有机层加硫酸反萃取得到硫酸铁溶液,从而与有机层分离。萃取反应为:Fe2(SO4)3(水层)+6HA(有机层)=2FeA3(有机层)+3H2SO4(水层)
①提高萃取效率的措施有__________。
A 适当提高萃取剂的浓度 B 适当提高溶液酸度
C 充分振荡,多次萃取 D 不断地从下层排除出有机层
②在反萃取中加硫酸的作用是___________。
(3)萃取后的水溶液制备Mg CO3·3H2O的实验方案:滴加氨水调节溶液的pH在一定范围内,过滤。向滤液中滴加Na2 CO3溶液,搅拌、静置、过滤,用水洗涤固体2~3次,在50℃下干燥,得到Mg CO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
①调节溶液pH的范围____________。
②判断向滤液中滴加Na2CO3溶液过量的方法__________。
(4)从废渣制备Mg CO3·3H2O的整体实验方案看,酸溶时所加H2SO4不宜过量太多的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
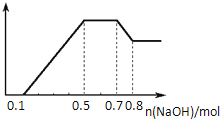
A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制取乙酸乙酯,下列说法中不正确的是( )
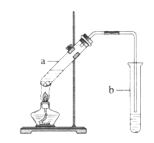
A.及时将乙酸乙酯蒸出,平衡向生成乙酸乙酯的方向移动
B.向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
C.试管b中导气管下端不能浸入液面的目的是防止实验过程中产生倒吸现象
D.反应结束后用分液的方法分离试管b中的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________种运动状态不同的电子,Fe3+基态核外电子排布式为_______________。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________(用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________;HCN中C原子轨道的杂化类型为__________。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________,其中Fe的配位数为_____________。

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,![]() ,
,![]() )、(
)、(![]() ,0,
,0,![]() )和(
)和(![]() ,
,![]() ,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,高度对称的有机分子具有致密性高、稳定性强、张力能大等特点。饱和烃中有一系列高度对称结构的烃,如![]() (正四面体烷C4H4)、
(正四面体烷C4H4)、![]() (棱晶烷C6H6)、
(棱晶烷C6H6)、![]() (立方烷C8H8),下列有关说法正确的是
(立方烷C8H8),下列有关说法正确的是
A.上述三种物质中的C原子都形成4个单键,因此它们都属于烷烃
B.上述三种物质互为同系物,它们的通式为C2nH2n(n≥2)
C.棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物的数目不同
D.棱晶烷与立方烷在光照条件下均可与氯气发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
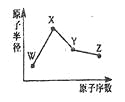
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式_________,E2+价电子的轨道表示式_________________。
(2)这5种元素中电负性最大的元素是_____(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃的混合物共0.1 mol ,充分燃烧后得3.584 L(标准状况下)CO2和3.6 g水,下列说法正确的是( )
A. 一定有甲烷B. 一定有乙烯C. 可能有乙烷D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com