
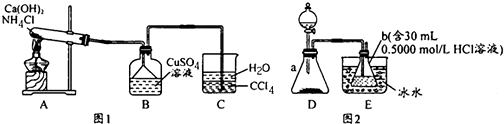
分析 (1)A为实验室用氯化铵与氢氧化钙制备氨气的反应;
(2)氨气极易溶于水,难溶于四氯化碳;
(3)Cu(NH3)xSO4•H2O在乙醇中的溶解度较小,在Cu(NH3)xSO4溶液加入无水乙醇会析出Cu(NH3)xSO4•H2O晶体;
(4)Cu(NH3)xSO4与NaOH反应生成氢氧化铜沉淀和氨气;
(5)Cu(NH3)xSO4•H2O与氢氧化钠反应生成的氨气被盐酸吸收,再用氢氧化钠滴定剩余的盐酸,根据消耗的氢氧化钠求出与氨气反应的盐酸,以及氨气的物质的量,根据晶体与氨气的物质的量的关系求出x;
若生成的氨气偏少或氨气没有完全逸出,则氨气的物质的量偏小,x值偏小;
若步骤三中测定结束读数时,体积读数偏小,则与氢氧化钠反应的盐酸偏少,与氨气反应的盐酸偏多,计算出的氨气的物质的量偏大;
(6)步骤一中用于称量的天平砝码腐蚀缺损,应该更换砝码和天平,重新作该实验.
解答 解:(1)A为实验室用氯化铵与氢氧化钙制备氨气,化学方程式为:Ca(OH)2+2NH4Cl 2NH3↑+CaCl2+2H2O;
故答案为:Ca(OH)2+2NH4Cl 2NH3↑+CaCl2+2H2O;
(2)氨气极易溶于水,氨气不溶于四氯化碳,把氨气通入四氯化碳不溶解,不会产生倒吸,氨气在向上逸出时被水吸收;
故答案为:防止倒吸;
(3)Cu(NH3)xSO4•H2O在乙醇中的溶解度较小,在Cu(NH3)xSO4溶液加入无水乙醇会析出Cu(NH3)xSO4•H2O晶体;
故答案为:无水乙醇;
(4)Cu(NH3)xSO4与NaOH反应生成氢氧化铜沉淀和氨气,则其反应的离子方程式为:Cu(NH3)x2++2OH-=Cu(OH)2↓+xNH3↑;
故答案为:Cu(NH3)x2++2OH-=Cu(OH)2↓+xNH3↑;
(5)滴定消耗的氢氧化钠为n(NaOH)=cV=0.5000mol/L×0.01600L=0.008000mol,则与氢氧化钠反应的盐酸为0.008000mol,
与氨气反应的盐酸为:0.5000mol/L×0.0300L-0.008000mol=0.007000mol,所以氨气的物质的量为0.007000mol;
由(NH3)xSO4•H2O~xNH3,
1 x
$\frac{0.4690}{178+17x}$mol 0.007000mol
$\frac{0.4690}{178+17x}$×x=0.007000,解得:x=3.56;
若加入的NaOH溶液不足或者NaOH溶液浓度过低,Cu(NH3)xSO4没有完全反应,生成的氨气偏少,若没有加热则生成氨气不能从溶液中挥发出来,会使盐酸中吸收的氨气偏少,或氨气没有完全逸出,氨气的物质的量偏小,则x值偏小;
若步骤三中测定结束读数时,标准溶液体积读数偏小,则与氢氧化钠反应的盐酸偏少,而与氨气反应的盐酸偏多,氨气与盐酸等物质的量反应,则测定的氨气的物质的量偏多,计算出的x值偏大,所以假设不成立;
故答案为:3.56;加入的NaOH溶液不足、没有加热、生成的氨气未完全逸出、NaOH溶液浓度过低等;不成立;
(6)步骤一中用于称量的天平砝码腐蚀缺损,应该更换砝码和天平,重新作该实验;
故答案为:更换砝码完好的托盘天平后,重新进行步骤一到步骤三的全部实验.
点评 本题考查了物质的制备实验方案的设计、物质组成的测定,题目难度中等,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力、计算能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是
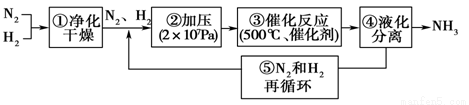
A.①②③ B.②④⑤ C.①③⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
(1)①0.01mol/LNaOH 溶液的pH= 。
溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4种离子:X+、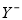 、H+、OH-下列分析结果肯定错误的是( )。
、H+、OH-下列分析结果肯定错误的是( )。
A.CY->CX+>CH+>COH-  B.CX+>CY->COH->CH+
B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是(  )
)
A.C(CH3COO-)<C(Na+)
B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH)
D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
下列各变化中不属于原电池的反应的是( )
A.为防止轮船外壳生锈,在船底装上锌块
B.镀锌铁表面锌有划损时,也能阻止铁被氧化
C.在空气中金属铝表面迅速氧化形成保护层
D.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(l)=H2(g)+ O2(g);△H= +242kJ·mol-1
O2(g);△H= +242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);△H= -484kJ·mol-1
C. H2(g)+ O2(g)=H2O(g);△H= +242kJ·mol-1
O2(g)=H2O(g);△H= +242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);△H= -484kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加入少量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 少量CO2通入苯酚钠溶液:2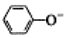 +CO2+H2O→2 +CO2+H2O→2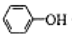 +CO32- +CO32- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液至溶液呈中性:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雨后彩虹”是与胶体、光学等知识有关的自然现象 | |
| B. | “百炼成钢”主要发生了物理变化 | |
| C. | “返青粽叶”指的是添加胆矾(CuSO4•5H2O)后的粽叶青绿新鲜,长期食用有害健康,其中胆矾是混合物 | |
| D. | “明矾净水”与漂白粉用于自来水消毒的原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com